��Ŀ����
����Ŀ��������ˮ�еĵ�Ԫ�ض���NH4+��NH3H2O����ʽ���ڣ�ij��������������ˮ���������£� ��NH4+�ķ�ˮ ![]() ��Ũ�Ȱ�����ˮ
��Ũ�Ȱ�����ˮ ![]() �����ȷ�ˮ
�����ȷ�ˮ ![]() ����ˮ
����ˮ
��1��I�м���NaOH��Һ����pH=11��������������������ӷ���ʽ��ʾ��NaOH��Һ�����������������������Ŀ���� ��
��2��II�м�������NaClO��Һ������pH��6��7��������ת��Ϊ�����ʣ� ��Ϊ����ȫ�ӷ�ˮ��ȥ�������������NaClO��ˮ����NH4+�����ʵ���֮����С�� ��
�ڹ��� II����3����Ӧ��
i��ClO��+H+�THClO
ii��NH4++HClO�TNH2Cl+H++H2O ��NH2Cl��ClԪ��Ϊ+1�ۣ�
iii�� ��
��֪��ˮ������+1����ʽ���ڵ���Ԫ��������ɱ�������ã�����Ϊ�����ȡ���ͼΪNaClO�������롰���ȡ������Ĺ�ϵʾ��ͼ�����а���������͵ĵ���c�㣮
b���ʾ����Һ�е�Ԫ�ص���Ҫ������ʽ�ǣ��û�ѧʽ��ʾ������Ӧiii�Ļ�ѧ����ʽ�� �� 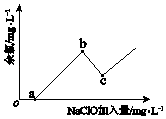
��3��III����Na2SO3��Һ���������ȷ�ˮ��Ҫ�����ˮ��ʣ��Na2SO3�ĺ���С��5mgL��1 �� �������ȷ�ˮ��NaClO�ĺ�����7.45mgL��1 �� ����10m3�����ȷ�ˮ����������10% Na2SO3��Һkg����Һ����仯���Բ��ƣ���
���𰸡�
��1��NH4++OH���TNH3?H2O���������Խ����ɵİ�������,ʹ��ѧƽ��������Ӧ�����ƶ�,�ٽ��˰�ˮ����
��2��3��1�� NH2Cl�� ClO��+2NH2Cl=N2+3Cl��+2H++H2O
��3��1.76
���������⣺��1������ܺ�ǿ�Ӧ��ʵ���ǣ�NH4++OH���TNH3H2O����ˮ�����ǿ��淴Ӧ������������������ɵİ������ߣ����������������ʹ��ѧƽ��������Ӧ�����ƶ�������������ɰ���������ٽ��˰�ˮ���룬
���Դ��ǣ�NH4++OH���TNH3H2O���������Խ����ɵİ������ߣ�ʹ��ѧƽ��������Ӧ�����ƶ����ٽ��˰�ˮ���룻��2���ٰ�����ˮ�еĵ�Ԫ�ض���NH4+��NH3H2O����ʽ���ڣ�Ϊ����ȫ�ӷ�ˮ��ȥ��������
2NH4+��N2��12e��
6ClO����6Cl����12e��
���ݵ����غ�õ������NaClO��ˮ����NH4+�����ʵ���֮��3��1��
���Դ��ǣ�3��1������a��b�㣬�����ķ�ӦΪi��ClO��+H+�THClO
ii��NH4++HClO�TNH2Cl+H++H2O ��NH2Cl��ClԪ��Ϊ+1�ۣ���b���ʾ����Һ�е�Ԫ�ص���Ҫ������ʽ��NH2Cl��
b��c�㷴Ӧ�Ǵ������ƺ�NH2Cl����������ԭ��Ӧ���ɵ�������Ӧ�����ӷ���ʽΪ��ClO��+2NH2Cl=N2+3Cl��+2H++H2O��
���Դ��ǣ�NH2Cl��ClO��+2NH2Cl=N2+3Cl��+2H++H2O����3������10m3��ˮb�к���NaClO�����ʵ���Ϊn= ![]() =1mol
=1mol
���ݷ�Ӧ��NaClO+Na2SO3�TNaCl+Na2SO4����֪��NaClO��ȫ��Ӧ���ĵ�Na2SO3Ϊ1mol��
����Ϊm=n��M=1mol��126g/mol=126g��
�������⣬���������10%Na2SO3��Һ������Ϊx
![]() =5mg/L��
=5mg/L��
��ã�x=1760g=1.76kg��
���Դ��ǣ�1.76��

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�����Ŀ����ͼ��ʾ����֤�������ʵ���ʵ�飬a��b��d��e�ǽ��������Һ����ֽ����KMnO4����μ�һ��Ũ�������������һ������������档��֪��2KMnO4��16HCl�D��2KCl��5Cl2����2MnCl2��8H2O
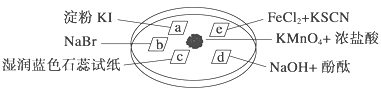
��ʵ������������ͻ��������ȷ���� (����)
ѡ�� | ʵ������ | ���ͻ���� |
A | a��������b�������ɫ | �����ԣ�Cl2>Br2>I2 |
B | c���ȱ�죬����ɫ | ������ˮ�������������� |
C | d��������ɫ | ������ˮ������Ư�������� |
D | e�����ɫ | ��ԭ�ԣ�Fe2��>Cl�� |
A. A B. B C. C D. D