题目内容
14.将ag水煤气(成分为CO和H2)充分燃烧,将燃烧生成的气体(150℃)通过盛有过量的Na2O2的干燥管(反应气体无损失),充分反应后干燥管增重bg,则a和b的关系为( )| A. | a=b | B. | a>b | C. | a<b | D. | 无法比较 |
分析 CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;
H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,以此解答.
解答 解:CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;
H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,
综上分析,最终固体增重为CO与氢气的总质量,故agCO和H2的混合气点燃后,再通入足量的Na2O2中,充分反应后,固体增重质量是ag,即b=a,
故选A.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意利用差量法从总反应方程式分析固体质量变化,是解答该题的关键.

练习册系列答案
相关题目
4.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应且都产生H2的是( )
| A. | 核内无中子的原子 | |
| B. | 外围电子排布为3s23p3 | |
| C. | 最外层电子数等于倒数第三层的电子数的原子 | |
| D. | N层上无电子,最外层的电子数等于电子层数的金属原子 |
5.下列说法正确的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 共价化合物中只有极性键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 非极性键只存在于单质分子中 |
2.A和B两元素能形成AB2 型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和6 | C. | 20和8 | D. | 20和17 |
9.阿司匹林是人们熟知的感冒药,是第一个重要的人工合成药物,具有解热镇痛作用.其化学名为乙酰水杨酸,可由水杨酸与乙酸酐直接反应制得,二者的结构简式为: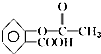 (阿司匹林)、
(阿司匹林)、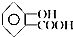 (水杨酸).下列有关二者所含官能团的说法正确的是( )
(水杨酸).下列有关二者所含官能团的说法正确的是( )
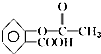 (阿司匹林)、
(阿司匹林)、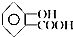 (水杨酸).下列有关二者所含官能团的说法正确的是( )
(水杨酸).下列有关二者所含官能团的说法正确的是( )| A. | 均含有碳碳双键 | B. | 均含酯基和羟基 | C. | 均为芳香化合物 | D. | 均含羧基和苯基 |
19.将0.1mol的镁、铝混合物完全溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.在滴加NaOH溶液的过程中,当沉淀达到最大值时所加入NaOH溶液的体积为( )
| A. | 100mL | B. | 200mL | C. | 300mL | D. | 400mL |
6.下列叙述正确的是( )
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | 水玻璃是一种矿物胶,黏性强,性质稳定,在空气中不易变质 | |
| D. | 石英玻璃是纯净物 |
3.将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应是( )
| A. | 只有AgBr沉淀生成 | B. | 生成等物质的量的AgCl与AgBr沉淀 | ||
| C. | AgCl沉淀的物质的量少于AgBr | D. | AgCl沉淀的物质的量大于AgBr沉淀 |
4.下列各组元素中,已知A、B两种元素的原子序数,其中可组成AB3型离子化合物的是( )
| A. | 6和9 | B. | 13和9 | C. | 11和8 | D. | 12和17 |