题目内容
13.化学与工农业生产和人类生活密切相关.下列说法中,正确的是( )| A. | 光导纤维、聚酯纤维、棉花都属于高分子化合物 | |
| B. | 在大米酿酒的过程中,淀粉最后变成了单糖 | |
| C. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| D. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 |
分析 A.高分子化合物,是指那些由众多原子或原子团主要以共价键结合而成的相对分子量在一万以上的化合物.按来源分类可把高分子分成天然高分子和合成高分子两大类;
B.淀粉水解生成葡萄糖,葡萄糖分解生成酒精;
C.泡沫灭火器的药品是碳酸氢钠和硫酸铝;
D.锌比铁活泼,可做原电池的负极.
解答 解:A.聚酯纤维是化学纤维的一种属于合成高分子,棉花属于天然高分子,两者都属于高分子化合物,光导纤维主要成分是二氧化硅,不是高分子化合物,故A错误;
B.淀粉水解生成葡萄糖,葡萄糖分解生成酒精,故B错误;
C.泡沫灭火器的药品是碳酸氢钠和硫酸铝,碳酸氢钠和硫酸铝反应生成大量的二氧化碳,其反应速率比碳酸钠和硫酸铝反应速率大,故C错误;
D.锌比铁活泼,可做原电池的负极,保护铁不被氧化,此为牺牲阴极的阳极保护法,故D正确;
故选D.
点评 本题考查较为综合,侧重于化学与生活、环境的考查,为高频考点和常见题型,有利于培养学生良好的科学素养,提高学习的积极性,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
3.能正确表示下列反应离子方程式的是( )
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | 用两根铜棒电解稀盐酸:2H++2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O+4H+═SO42-+3S↓+2H2O |
4.根据下表信息回答以下问题(均为短周期元素):
(1)在下表中用元素符号标出A、B、C、F的位置
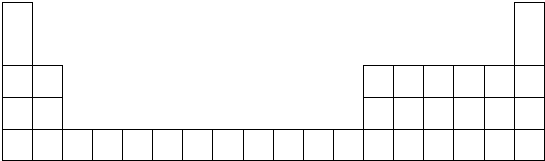
(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 | 0.152 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1,-1 | +7,-1 |

(2)C、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Be(OH)2+2H+═Be2++2H2O.
(3)F在E中燃烧的化学反应方程式:4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O
(4)设计简单试管实验证明D元素与H元素的非金属性强弱关系:将氯水滴入硫化钠溶液中,若有淡黄色沉淀生成可证明氯气氧化性大于S,从而证明非金属性Cl>S.
1.下列说法正确的是( )
| A. | 氢键不是化学键 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
8.下列说法正确的是( )
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④中心原子采取sp3杂化的分子,其立体构型不一定是正四面体
⑤氢键不仅存在于分子之间,有时也存在于分子内
⑥3p2表示3p能级有两个轨道.
| A. | ③④⑤ | B. | ①②③④⑤ | C. | ②③④ | D. | ②③④⑤⑥ |
18.CH2=C(CH3)-COOH,它不可能具有的性质是( )
| A. | 使酸性高锰酸钾溶液褪色 | B. | 发生加聚反应 | ||
| C. | 与银氨溶液反应 | D. | 与纯碱反应 |
6.对于反应:N2(g)+3H2(g)?2NH3(g),△H<0 的平衡体系,在其它条件不变时,采取下列措施,其中能既使正、逆反应速率增大,又能使反应物转化率增大的是( )
| A. | 增大体系压强 | B. | 升温 | C. | 加入铁触媒 | D. | 减小NH3的浓度 |
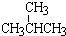 和
和 ; ⑧
; ⑧
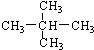 .
. 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.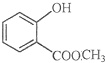 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.