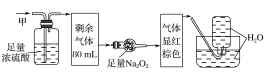
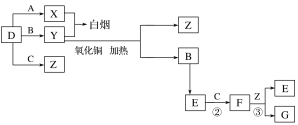
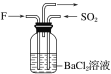
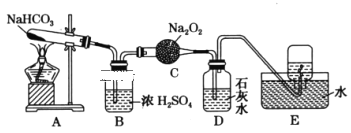
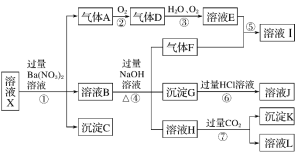
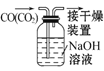
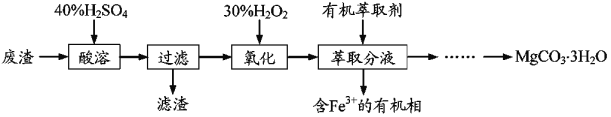
��Ŀ����
����Ŀ��(1)3.01��1023��NH4+�������ӵ����ʵ�����______mol�����е��ӵ����ʵ�����______mol��
(2)200mL 2mol/L��Al2(SO4)3 ��Һ��SO42-�����ʵ���Ũ��Ϊ_________��
(3)��״����36g H2��O2��ɵĻ������������67.2L �������ֻ��������H2��O2�������Ϊ____________��
(4)ͬ��ͬѹ�£�������Ϊ17��48��NH3��CH4�������壬�ܶ�֮��Ϊ_________��
(5)��֪1.505��1023��A�����������Ϊ31g ����A�����Ħ��������_________��
���𰸡�5.5mol 5mol 6mol 2:1 3:1 128g/mol
��������
(1)���ӵ����ʵ���n=![]() �����һ�������е����������������������ӵ����ʵ��������������õ����ӵ����ʵ��������ӵ����ʵ������Ե������õ����ӵ����ʵ�����
�����һ�������е����������������������ӵ����ʵ��������������õ����ӵ����ʵ��������ӵ����ʵ������Ե������õ����ӵ����ʵ�����
(2)Al2 (SO4)3���������Ũ�ȵ���Al2 (SO4)3��Ũ�ȳ���3��
(3)��״����36g H2��O2��ɵĻ������������67.2L��������������Եõ������ʵ����������������������ʵ����г���Ԫһ�η��̣����Եõ����ʵ���֮�ȣ��������������֮�ȵ������ʵ���֮�ȵõ��𰸣�
(4)ͬ��ͬѹ�£� NH3��CH4����������ܶ�֮�ȵ�����Է�������֮�ȣ����Եõ��𰸣�
(5)����n=![]() ������ʵ���n=
������ʵ���n=![]() ��M=
��M=![]() ��
��
(1)n(NH4+)=![]() =
=![]() =0.5mol��һ��NH4+����11�����ӣ�10�����ӣ������������ʵ���Ϊ0.5mol��11=5.5mol�����е������ʵ���Ϊ0.5mol��10=5mol��
=0.5mol��һ��NH4+����11�����ӣ�10�����ӣ������������ʵ���Ϊ0.5mol��11=5.5mol�����е������ʵ���Ϊ0.5mol��10=5mol��
(2). 200mL 2mol/L��Al2 (SO4)3 ��Һ��SO42-�����ʵ���Ũ�ȵ���2mol/L��3=6 mol/L��
(3)��״����36gH2��O2��ɵĻ������������67.2L��������������ʵ���=![]() =3mol�������������ʵ���Ϊx�����������ʵ���Ϊy���� x+y=3��2x+32y=36�����x=2��y=1������£���������ʵ���֮�ȵ������֮�ȵ���2:1��
=3mol�������������ʵ���Ϊx�����������ʵ���Ϊy���� x+y=3��2x+32y=36�����x=2��y=1������£���������ʵ���֮�ȵ������֮�ȵ���2:1��
(4)ͬ��ͬѹ�£�NH3��CH4����������ܶ�֮�ȵ�����Է�������֮��17:16��
(5)n(A)=![]() =
=![]() =0.25mol����A�����ʵ���n=
=0.25mol����A�����ʵ���n=![]() ��M=
��M=![]() =
=![]() =128g/mol��
=128g/mol��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��ij���жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5(ֱ��С�ڵ���25��m������������)������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش���������:
��1��PM2.5��ɢ�ڿ������γɵķ�ɢϵ___(����������,����������)���塣
��2����PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±�:
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��(mol/L) | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������жϴ�������Ϊ___(��������������)��,��ʾ����������Ե�c(H+)��c(OH-)=_______mol/L��
��3��úȼ���ŷŵ���������SO2��NOx���γ����꣬��Ⱦ����������NaClO2��Һ�ڼ��������¿ɶ�������������������Ч���dz��á�������ж������������̵����ӷ���ʽ��
___ClO2-+__NO+____=___Cl-+___NO3-+___��________________
��4��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ��:
����úת��Ϊ�������ȼ�ϡ�д����̿��ˮ������Ӧ�Ļ�ѧ����ʽ___________��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ�����___________��
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
��5������β����NOx��CO�����ɼ�ת����
�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��д������������NO��ѧ����ʽ_______________��
������ȼ�Ͳ���ȫȼ��ʱ����CO��Ŀǰ��������β��ϵͳ��װ�ô�ת�����ɼ���CO��NO����Ⱦ���仯ѧ��Ӧ����ʽΪ_______________��