题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN﹣,Cl﹣
B. ![]() =1×10﹣12的溶液中:K+、Na+、CO32﹣、NO3﹣
=1×10﹣12的溶液中:K+、Na+、CO32﹣、NO3﹣
C. 酸性溶液中;Na+、ClO﹣,SO42﹣,I﹣
D. 能溶解Al2O3的溶液中:Na+、Fe2+、HS﹣、SO42﹣
【答案】B
【解析】
A项、无色溶液中不存在Fe3+,且溶液中Fe3+与SCN﹣发生络合反应不能大量共存,故A错误;
B项、![]() =1×10﹣12为碱性溶液,碱性溶液中K+、Na+、CO32﹣、NO3﹣离子之间不反应,能大量共存,故B正确;
=1×10﹣12为碱性溶液,碱性溶液中K+、Na+、CO32﹣、NO3﹣离子之间不反应,能大量共存,故B正确;
C项、酸性溶液中ClO﹣与I﹣发生氧化还原反应不能大量共存,故C错误;
D项、能溶解Al2O3的溶液可能为酸溶液或碱溶液,HS-既能与酸反应又能与碱反应,在溶液中不能大量共存,故D错误;
故选B。

 智能训练练测考系列答案
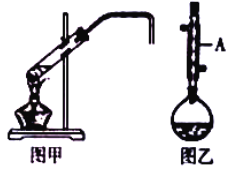
智能训练练测考系列答案【题目】化学实验小组欲在实验室制备溴乙烷(图甲)和1﹣溴丁烷(图乙),涉及化学反应如下:
NaBr+H2SO4═HBr+NaHSO4 ①
C2H5﹣OH+HBrC2H5﹣Br+H2O ②
CH3CH2CH2CH2﹣OH+HBrCH3CH2CH2CH2﹣Br+H2O ③
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br﹣被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1﹣溴丁烷 | |
密度/gcm﹣3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 111.6 |
请回答下列问题:
(1)图乙中仪器A的名称为_____。
(2)乙醇的沸点高于溴乙烷的沸点,其原因是_____。
(3)将1﹣溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在_____(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是_____。(填字母)
A.减少副产物烯和醚的生成
B.减少Br2的生成
C.减少HBr的挥发
D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____。(填字母)
A.NaIB.NaOHC.NaHSO3D.KCl
(6)制备溴乙烷(图甲)时,采用边反应边蒸出产物的方法,其有利于_____;但制备1﹣溴丁烷(图乙)时却不能边反应边蒸出产物,其原因是_____。