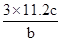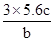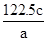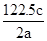题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA |
C
试题分析:A、25℃时,pH=13的氨水中OH-的浓度是0.1mol/L,但不能确定溶液的体积,因此不能计算OH-的数目,A不正确;B、标准状况下,2.24 LNO2的物质的量=
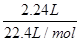 =0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是
=0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是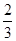 ×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
练习册系列答案
相关题目