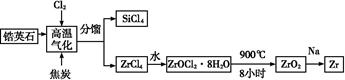
题目内容
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康
(1)含有较多______________的水称为硬水,硬水加热后产生沉淀的离子方程式为__________________________( 写出生成一种沉淀物的即可) 。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
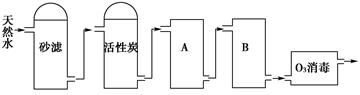
①活性炭的作用是__________________;O3消毒的优点是________________。
②A、B中放置的物质名称分别是:A__________________;B_______________。A、B中放置的物质是否可以互换?请说明原因________________________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某 城 市 用 水 中c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3_)为8.0×10-4mol/L。如用药剂软化该1000L ,应加入Ca(OH) 2 g , Na2CO 3 __________ g 。
(1)含有较多______________的水称为硬水,硬水加热后产生沉淀的离子方程式为__________________________( 写出生成一种沉淀物的即可) 。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:

①活性炭的作用是__________________;O3消毒的优点是________________。
②A、B中放置的物质名称分别是:A__________________;B_______________。A、B中放置的物质是否可以互换?请说明原因________________________________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某 城 市 用 水 中c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3_)为8.0×10-4mol/L。如用药剂软化该1000L ,应加入Ca(OH) 2 g , Na2CO 3 __________ g 。
(1)C a2+、 M g2+ (2分)C a2++ 2 H C O3— 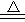 CaC O 3↓+C O 2↑+
CaC O 3↓+C O 2↑+
H 2O( 或 Mg2++ 2HCO3— MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O )(2分)
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O )(2分)
(2)①吸附水中的有机物(或去除水中的异味)(1分)②反应产物无毒无害 阳子交换树脂 阴离子交换树脂(2分)水中的Ca2+、Mg2+会与阴离子树脂中的OH- 生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂(1分)
(3)反渗透法 (1分)电势差或电场力(1分)
(4)电导率或电阻率(1分)(5)66.6 (2分) 116.6(2分)
 CaC O 3↓+C O 2↑+
CaC O 3↓+C O 2↑+H 2O( 或 Mg2++ 2HCO3—
 MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O )(2分)
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O )(2分)(2)①吸附水中的有机物(或去除水中的异味)(1分)②反应产物无毒无害 阳子交换树脂 阴离子交换树脂(2分)水中的Ca2+、Mg2+会与阴离子树脂中的OH- 生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂(1分)
(3)反渗透法 (1分)电势差或电场力(1分)
(4)电导率或电阻率(1分)(5)66.6 (2分) 116.6(2分)
试题分析:(1)考查硬水的概念。含有较多Ca2+、Mg2+的水是硬水。在加热的条件下,碳酸氢盐可以分解生成碳酸盐,C a2++ 2 HCO3-
 CaCO 3↓+CO 2↑+H 2O( 或Mg2++2HCO3-
CaCO 3↓+CO 2↑+H 2O( 或Mg2++2HCO3- MgCO3↓+CO2↑+H2O 、MgCO3+2H2O=Mg(OH)2+CO2↑+H2O );
MgCO3↓+CO2↑+H2O 、MgCO3+2H2O=Mg(OH)2+CO2↑+H2O );(2)①活性炭的作用为吸附水中的有机物(或去除水中的异味)②O3消毒的优点是反应产物无毒无害,A为阳离子交换树脂,B为阴离子交换树脂,水中的Ca2+、Mg2+会与阴离子树脂中的OH- 生成Mg(OH)2、Ca(OH)2沉淀造成堵塞,损坏离子交换树脂;
(3)电渗析法是一种利用离子交换膜进行海水淡化的方法.在外加电场的作用下,水溶液中阴、阳离子会分别向两极移动,如果在中间加上一种交换膜,就可能达到分离浓缩的目的.所以电渗析法净化水时,使离子通过半透膜的推动力是电势差或电场力.故答案为:反渗透法;电势差(或电场力);
(4)因为水的电离程度极小,所以纯水是几乎不导电的,因此要检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率;
(5)c(Ca2+)为1.0×10-3mol·L-1,c(Mg2+)为5.0×10-4mol·L-1,c(HCO3-)为8.0×10-4mol·L-1.如用药剂软化该1000L,
n(Ca2+)=1000L×1.0×10-3mol·L-1=1mol,n(Mg2+)=1000L×5.0×10-4mol·L-1=0.5mol,n(HCO3-)=1000L×8.0×10-4mol·L-1=0.8mol,
加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓
0.5mol 1mol
HCO3-+OH-=CO32-+H2O
0.8mol 0.8mol
共需要n(OH-)=1.8mol,
则需要Ca(OH)2的质量为1.8mol×
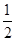 ×74g·mol-1=66.6g,
×74g·mol-1=66.6g,水溶液中Ca2+物质的量为1mol+0.9mol=1.9mol,
其中需要加入的碳酸根离子为1.9mol-0.8mol=1.1mol,其质量为1.1mol×106g·mol-1=116.6g,
故答案为:66.6;116.6。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl ④H2MoO4
2MoO3+4SO2 ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl ④H2MoO4