题目内容
随着全球淡水资源危机日益严重,世界各国都把目光投向了占全球总水量约97%的汪洋大海,希望从苦涩的海水中提取可以饮用的淡水。
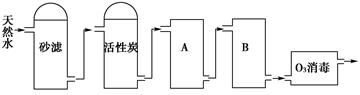
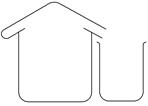
(1)海水淡化由来已久。二次大战时,一艘为盟军运送军事物资的商船遇难漂流到一座荒岛上。为了获取淡水,船员们将救生艇上的铜皮空气箱拆下,在空气箱上加盖一块边缘向内卷曲形成水槽的铜盖,做成一个简易蒸馏器。加热箱内的海水,水蒸气在盖顶冷凝后顺着边缘流进水槽。再滴入淡水桶内。根据上述文字的描述,为下图简易蒸馏器示意图补画铜盖。
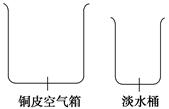
(2)海水淡化亦称海水脱盐。该工艺过程包括海水预处理、脱盐、淡化水的后处理等。下列属于海水预处理的是________(填序号)。
①淡水收集 ②除掉悬浮物 ③杀灭海洋生物 ④除掉海水中的盐分 ⑤水质检测 ⑥降低海水浑浊度
(3)为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是_________。
(1)海水淡化由来已久。二次大战时,一艘为盟军运送军事物资的商船遇难漂流到一座荒岛上。为了获取淡水,船员们将救生艇上的铜皮空气箱拆下,在空气箱上加盖一块边缘向内卷曲形成水槽的铜盖,做成一个简易蒸馏器。加热箱内的海水,水蒸气在盖顶冷凝后顺着边缘流进水槽。再滴入淡水桶内。根据上述文字的描述,为下图简易蒸馏器示意图补画铜盖。

(2)海水淡化亦称海水脱盐。该工艺过程包括海水预处理、脱盐、淡化水的后处理等。下列属于海水预处理的是________(填序号)。
①淡水收集 ②除掉悬浮物 ③杀灭海洋生物 ④除掉海水中的盐分 ⑤水质检测 ⑥降低海水浑浊度
(3)为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是_________。
(1)如图
(2)②③⑥ (3)AgNO3溶液和稀硝酸

(2)②③⑥ (3)AgNO3溶液和稀硝酸
(2)中①⑤属于海水淡化后的处理,④属于脱盐,②③⑥属于海水预处理。 (3)检验Cl-的方法是加入硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目