题目内容
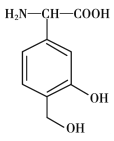
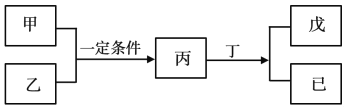
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
A. 原子半径:Z>Y>X>W
B. W、X、Y、Z不可能同存于一种离子化合物中
C. W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键
D. 比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性
【答案】C
【解析】
Y元素在同周期中离子半径最小,金属离子外的电子层数比相应的原子少一层,而且同周期金属元素离子半径随着原子序数的递增而减小,而非金属元素的离子的电子层没有减少,所以Y应为Al元素。丁为二元化合物,而且为液态,为水。丙与水反应得到两种物质,而且一种为酸。0.01mol·L-1戊溶液的pH大于2,为弱酸。短周期中二元化合物为弱酸的HF和H2S。结合乙是Z的单质,Z的原子序数比Al大,Z为S元素。涉及的反应为2Al+3S![]() Al2S3,Al2S3+6H2O=2Al(OH)3+3H2S↑。W、X、Y、Z分别为H、O、Al、S。
Al2S3,Al2S3+6H2O=2Al(OH)3+3H2S↑。W、X、Y、Z分别为H、O、Al、S。
A.H原子半径最小。同周期的元素,原子序数越大,原子半径越小,Al原子的半径大于S;同主族元素,原子序数越大,原子半径越大,S的原子半径大于O,排序为Y(Al)> Z(S)> X(O)> W(H),A项错误;
B.H、O、Al、S可以存在于KAl(SO4)2·12H2O中,存在离子键,为离子化合物,B项错误;
C.W(H)和X(O)的化合物可能为H2O和H2O2。H2O的结构简式为H—O—H,含有极性键。H2O2的结构简式为H—O-O—H,含有极性键和非极性键,C项正确;
D.比较X(O)和Z(S)的非金属性,不能比较最高价氧化物对应的水化物的酸性,因为O没有它的含氧酸。D项错误;
本题答案选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案