题目内容
16.A~K分别代表九种不同的有机物.它们之间的相互转化关系如图:
(1)A的结构式为;F的结构简式为;指出C→G的反应类型酯化反应.
(2)写出下列转化的化学方程式
①C→DHOCH2CH2OH+O2$→_{△}^{Cu}$OHC-CHO+2H2O
②G→Hn CH2=CHCOOCH2CH2OH$\stackrel{一定条件下}{→}$

(3)与有机物Ⅰ互为同分异构体,且结构中含有羧基和羟基的有机物共有12种.
(4)已知标准状况下1.68L气体A在足量氧气中完全燃烧,若将产物通入足量的澄清石灰水,得到白色沉淀的质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g.
①燃烧产物中水的质量为2.7g.
②假如气体A是两种等物质的量的气体混合物,其中只有一种是烃,请写出它们可能的分子式(只要求写出一组)C4H6和H2(或“C3H8和CO”或“C3H6和CH2O”等).
分析 C能在Cu加热条件下与氧气反应,D能与氢氧化铜反应生成E,C含有羟基-OH,D含有醛基,E含有羧基,且三者含有相同碳原子数目,C、E生成F,F的分子式为C4H4O4,故C中含有2个C原子,由A、B、C的转化可知,A中含有2个C原子,能与溴反应,含有不饱和键,故A为CH2=CH2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,F为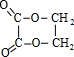 ,由G的分子式可知,乙二醇与丙烯酸发生酯化反应生成G,K为CH2=CHCOOH,G为CH2=CHCOOCH2CH2OH,由I的分子式可知,乙二醇与CH3CH2COOH发生酯化反应生成I,J为CH3CH2OH,I为CH3CH2COOCH2CH2OH,据此解答(1)(2)(3);
,由G的分子式可知,乙二醇与丙烯酸发生酯化反应生成G,K为CH2=CHCOOH,G为CH2=CHCOOCH2CH2OH,由I的分子式可知,乙二醇与CH3CH2COOH发生酯化反应生成I,J为CH3CH2OH,I为CH3CH2COOCH2CH2OH,据此解答(1)(2)(3);
(4)根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,二氧化碳与足量的氢氧化钙完全反应,生成不溶于水的白色沉淀碳酸钙,利用生成碳酸钙的质量计算燃烧生成二氧化碳的质量;碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和,从而求出水的质量,根据生成二氧化碳和水的质量计算出可燃物中C、H元素的物质的量,再根据条件求出分子式.
解答 解:C能在Cu加热条件下与氧气反应,D能与氢氧化铜反应生成E,C含有羟基-OH,D含有醛基,E含有羧基,且三者含有相同碳原子数目,C、E生成F,F的分子式为C4H4O4,故C中含有2个C原子,由A、B、C的转化可知,A中含有2个C原子,能与溴反应,含有不饱和键,故A为CH2=CH2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,F为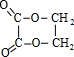 ,由G的分子式可知,乙二醇与丙烯酸发生酯化反应生成G,K为CH2=CHCOOH,G为CH2=CHCOOCH2CH2OH,由I的分子式可知,乙二醇与CH3CH2COOH发生酯化反应生成I,J为CH3CH2OH,I为CH3CH2COOCH2CH2OH,
,由G的分子式可知,乙二醇与丙烯酸发生酯化反应生成G,K为CH2=CHCOOH,G为CH2=CHCOOCH2CH2OH,由I的分子式可知,乙二醇与CH3CH2COOH发生酯化反应生成I,J为CH3CH2OH,I为CH3CH2COOCH2CH2OH,
(1)A为CH2=CH2,结构式为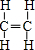 ;F的结构简式为
;F的结构简式为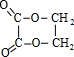 ,乙二醇与丙烯酸发生酯化反应生成G,
,乙二醇与丙烯酸发生酯化反应生成G,
故答案为: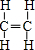 ;
;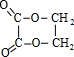 ;酯化反应;
;酯化反应;
(2)①C→D是乙二醇氧化生成乙二醛,反应方程式为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHC-CHO+2H2O,
②G→H是CH2=CHCOOCH2CH2OH发生加聚反应,反应方程式为:n CH2=CHCOOCH2CH2OH$\stackrel{一定条件下}{→}$ ,
,
故答案为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHC-CHO+2H2O;n CH2=CHCOOCH2CH2OH$\stackrel{一定条件下}{→}$ ;
;
(3)I为CH3CH2COOCH2CH2OH,与有机物Ⅰ互为同分异构体,且结构中含有羧基和羟基,可以看作丁烷中的氢原子被-OH、-COOH取代,
若丁烷为CH3CH2CH2CH3,若取代不同碳原子上的H原子,当-COOH取代甲基上H原子,-OH可以分别取代其它碳原子上H原子,有3种,当-COOH取代亚甲基上H原子,-OH可以分别取代其它碳原子上H原子,有3种;若取代同一碳原子上的H原子是有2种,有8种;
若丁烷为CH3CH(CH3)2,若取代不同碳原子上的H原子,当-COOH取代甲基上H原子,-OH可以分别取代其它碳原子上H原子,有2种,当-COOH取代次甲基上H原子,-OH可以分别取代其它碳原子上H原子,有1种,若取代同一碳原子上的H原子时有1种,有4种,
故符合条件的同分异构体总共有8+4=12,
故答案为:12;
(4)①设燃烧产物中CO2的质量为x.
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 15.0g
x=6.6g
而碱石灰既能吸收燃烧生成的水,又能吸收燃烧生成的二氧化碳,因此,增重的质量即燃烧生成二氧化碳和水的质量总和:m(CO2)+m(H2O)=9.3g,m(H2O)=9.3g-6.6g=2.7g,故答案为:2.7g;
②无色可燃气体n(气体)=$\frac{1.68L}{22.4L/mol}$=0.075mol,
n(CaCO3)=$\frac{15.0g}{100g/mol}$=0.15mol,则n(C)=0.15mol;
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则n(H)=n(H2O)×2=0.3mol,
即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,可能含有氧元素,所以该气体的分子式是C2H4或C2H4Ox(常温下不是气体);因为单一气体为C2H4,现为等物质的量的两种气体的混合物,所以在2mol混合气体中,应含有4molC原子,8molH原子,这两种气体可能是C4H6和H2(或“C3H8和CO”或“C3H6和CH2O”等),
故答案为:C4H6和H2(或“C3H8和CO”或“C3H6和CH2O”等).
点评 本题考查燃烧法确定有机物分子组成的知识以及有机物的推断,根据反应中碳原子数目关系确定物质C含有2个碳原子是推断的关键,再结合反应的条件及产物的分子式进行推断,(3)同分异构体书写为易错点、难度,注意利用取代法进行判断,难度中等.

| A. | CH4和CH3-CH2-CH3 | B. | C2H5-OH和C6H5-OH | ||
| C. | CH3-CH2-CH2-CH3和 | D. | C2H4和C3H4 |

| A. | “K”属于芳香烃 | |
| B. | “K”的苯环上的一硝基取代产物有5种 | |
| C. | “K”中含有三种官能团 | |
| D. | 11mol“K”最多可和6molH2发生加成反应 |

| A. | 该能量转化系统中的水也是可以循环的 | |
| B. | 燃料电池放电时的负极反应:H2-2e-+2OH-═2H2O | |
| C. | 水电解系统中的阳极反应:4OH--4e-═2H2O+O2↑ | |
| D. | 燃料电池系统产生的能量实际上来自于水 |


 、I
、I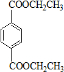 .
.
 .
.
 回答下列问题.
回答下列问题.