题目内容
7.下列物质中,既含离子键、又含极性共价键的是( )| A. | NaOH | B. | Na2O | C. | HCl | D. | CaCl2 |
分析 一般来说,活泼金属元素和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,据此分析解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A正确;
B.氧化钠中钠离子和氧离子之间只存在离子键,故B错误;
C.HCl分子中H-Cl原子之间只存在极性键,故C错误;
D.氯化钙中钙离子和氯离子之间只存在离子键,故D错误.
故选A.
点评 本题考查离子键、共价键判断,侧重考查基本概念,根据物质的构成微粒判断即可,注意D中两个氯离子之间不存在共价键,为易错点.

练习册系列答案
相关题目
17.如图是立方烷的球棍模型,下列有关说法正确的是( )
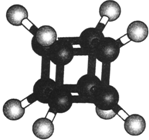

| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它不易燃烧 | |
| D. | 它与苯乙烯(C6H5-CH═CH2)不是同分异构体 |
15.水的电离平衡曲线如右图所示.下列说法正确的是( )


| A. | 图中对应点的温度关系为:a>b>c | |
| B. | 纯水仅升高温度,可从a点变到c点 | |
| C. | 水的电离常数KW数值大小关系为:b=d>c | |
| D. | 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
12.现有三组混合溶液:①乙酸乙酯和乙酸钠溶液 ②1-丁醇和乙醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
19.下列物质沸点最低的是( )
| A. | 庚烷 | B. | 新戊烷 | C. | 正戊烷 | D. | 2-甲基丁烷 |
16.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的( )
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
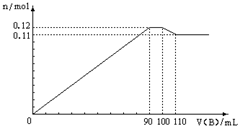 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示: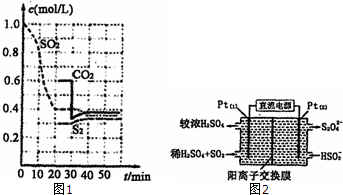 硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害.