题目内容
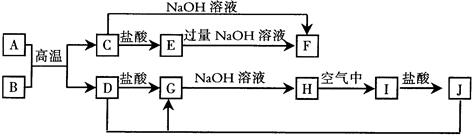
(10分)下列转化关系中,X、Y是生活中用处广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题
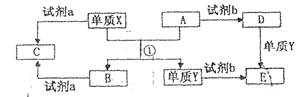
(1) 请写出反应①的化学方程式:______________
(2) 检验D溶液中问离子的方法是______________;
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式_______;
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制备一种髙效净水剂Y(OH)SO4,已知还原产物为N0,则该反应的化学方程式是_______;
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为_______kg。

(1) 请写出反应①的化学方程式:______________
(2) 检验D溶液中问离子的方法是______________;
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式_______;
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制备一种髙效净水剂Y(OH)SO4,已知还原产物为N0,则该反应的化学方程式是_______;
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为_______kg。
(10分) (1)Fe2O3+2Al 2Fe+Al2O3 (2分)
2Fe+Al2O3 (2分)
(2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;(2分)
(3)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑(2分) (5)54(2分)
 2Fe+Al2O3 (2分)
2Fe+Al2O3 (2分)(2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;(2分)
(3)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑(2分) (5)54(2分)
本题考查元素化合物性质及无机推断。无机推断题的解题关键是找到题眼。本题的题眼是“A、B是氧化物,A呈红棕色”,可知A是Fe2O3,则根据框图可推知,Y为Fe,再根据框图和“X、Y是生活中用处广泛的两种金属单质”可推知,X为Al,B为Al2O3,故反应①的化学方程式为Fe2O3+2Al 2Fe+Al2O3。溶液D中存在Fe3+。可用KSCN溶液检验,方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;若试剂a是NaOH溶液,则Al与NaOH溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑;若试剂b是H2SO4,则E为FeSO4, NaNO2为氧化剂,产物的髙效净水剂Y(OH)SO4为Fe(OH)SO4,则反应的化学方程式为2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑。电解熔融的Al2O3制取Al时,阳极产生氧气,物质的量为1.5mol,失去的电子的物质的量为6mol,由电子得失可知,阴极产物为Al,得到Al为2mol,质量为54g。
2Fe+Al2O3。溶液D中存在Fe3+。可用KSCN溶液检验,方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;若试剂a是NaOH溶液,则Al与NaOH溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑;若试剂b是H2SO4,则E为FeSO4, NaNO2为氧化剂,产物的髙效净水剂Y(OH)SO4为Fe(OH)SO4,则反应的化学方程式为2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑。电解熔融的Al2O3制取Al时,阳极产生氧气,物质的量为1.5mol,失去的电子的物质的量为6mol,由电子得失可知,阴极产物为Al,得到Al为2mol,质量为54g。
 2Fe+Al2O3。溶液D中存在Fe3+。可用KSCN溶液检验,方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;若试剂a是NaOH溶液,则Al与NaOH溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑;若试剂b是H2SO4,则E为FeSO4, NaNO2为氧化剂,产物的髙效净水剂Y(OH)SO4为Fe(OH)SO4,则反应的化学方程式为2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑。电解熔融的Al2O3制取Al时,阳极产生氧气,物质的量为1.5mol,失去的电子的物质的量为6mol,由电子得失可知,阴极产物为Al,得到Al为2mol,质量为54g。
2Fe+Al2O3。溶液D中存在Fe3+。可用KSCN溶液检验,方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+;若试剂a是NaOH溶液,则Al与NaOH溶液反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑;若试剂b是H2SO4,则E为FeSO4, NaNO2为氧化剂,产物的髙效净水剂Y(OH)SO4为Fe(OH)SO4,则反应的化学方程式为2FeSO4 + H2SO4 + 2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑。电解熔融的Al2O3制取Al时,阳极产生氧气,物质的量为1.5mol,失去的电子的物质的量为6mol,由电子得失可知,阴极产物为Al,得到Al为2mol,质量为54g。
练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目



 。
。 。
。