题目内容
8.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2、和水的总质量为27.6g,若其中水的质量是10.8g,则CO2的质量为( )| A. | 1.4 g | B. | 15.4 g | C. | 4.4 g | D. | 12.4 g |
分析 根据反应中生成水的质量可确定乙醇的物质的量,进而求出碳原子的物质的量,同时也是CO2和CO的物质的量和,分别设出二氧化碳、一氧化碳的物质的量,分别根据质量、物质的量列式计算即可.
解答 解:设乙醇的物质的量为x,
由C2H5OH~3H2O
1mol 54g
x 10.8g
则:$\frac{1mol}{x}$=$\frac{54g}{10.8g}$,
解得:x=0.2mol,
由乙醇的分子式可知:n(CO2)+n(CO)=0.2mol×2=0.4mol,
则m(CO2)+m(CO)=27.6g-10.8g=16.8g,
设产物中含有xmol二氧化碳、ymolCO,
则:①44x+28y=16.8g,②x+y=0.4,
联立①②解得:x=0.35、y=0.05,
所以二氧化碳的质量为:44g/mol×0.35mol=15.4g,
故选B.
点评 本题考查化学反应方程式的计算,题目难度中等,把握水的质量及CO、CO2的质量关系及守恒法计算为解答的关键,试题侧重对学生的分析与计算能力的考查.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )


| A. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有9种 | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 化合物Ⅱ中共含有4种官能团 | |
| D. | 可用溴水区分化合物Ⅱ和化合物Ⅲ |
16.糖尿病人的尿液中常含有葡萄糖,某同学设计了如下荒谬的检验方法:让患者服下新制的碱性氢氧化铜悬浊液1 h后,再观察病人的尿液中是否会有红色沉淀物.你认为下列解释不合理的是( )
| A. | 服进肠胃的药剂根本不会直接进入人的膀胱中,Cu(OH)2悬浊液无法与葡萄糖作用 | |
| B. | 所用药剂具有毒性(含重金属元素Cu)和强腐蚀性(含NaOH),不能内服 | |
| C. | 该同学设计是正确的,但由于体温达不到令Cu(OH)2悬浊液与葡萄糖反应的温度,故检验不会成功 | |
| D. | 由于人们吃入的淀粉在体内也能水解成葡萄糖,会干扰检验的现象,检验应空腹进行 |
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用,锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |
3.由同一种元素所构成的不同单质被称为同素异形体,下列哪组物质不属于同素异形体的是( )
| A. | 钢和铁 | B. | 金刚石和石墨 | C. | 红磷和白磷 | D. | 氧气和臭氧 |
17.下列互为同位素的是( )
| A. | H2和D2 | B. | O2和O3 | C. | CO和CO2 | D. | 12C和13C |
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题: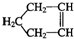 可简写为
可简写为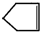 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: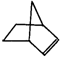
 .
.