题目内容
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
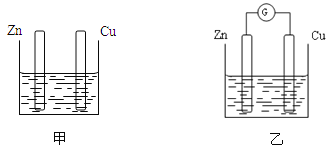
(1)以下叙述中,正确的是 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为 ,乙为 。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了少量气体,分析其原因可能是 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: 。
【答案】(1)C、D (2)化学能转化为热能 化学能转化为电能
(3)锌片不纯,在锌片上形成原电池(合理答案即可得分) (4)Cu2+ + 2e- = Cu
【解析】
试题分析:(1)A.甲中不具备构成原电池的条件,错误;B.在甲烧杯中没有构成原电池,Zn活动性强,能够与酸发生置换反应产生氢气而冒气泡,在Cu上无现象;在乙烧杯中,二种金属形成了原电池,由于 金属活动性Zn>Cu,所以Zn是负极,Cu是正极,在烧杯乙中铜片表面有气泡产生,错误;C.由于在两个烧杯中硫酸反应变为ZnSO4,溶液的酸性减弱,两烧杯中溶液的pH均增大,正确;D.原电池反应可以加快反应速率,所以产生气泡的速率甲中比乙中慢,正确;E.乙的外电路中电流方向Cu→Zn,错误。(2)变化过程中能量转化的形式主要是:甲为化学能变为热能,乙是化学能转化为电能;(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了少量气体,分析其原因可能是锌片不纯,在锌片上形成许多微小的原电池;(4)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜电极上是溶液中的Cu2+得到电子被还原,该电极反应方程式是:Cu2+ + 2e- = Cu。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+ , 该原电池的组成正确的是( )
Zn | A | B | C | D |
正极 | Fe | C(石墨) | Ag | Zn |
负极 | Cu | Fe | Fe | Fe |
电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D