题目内容
【题目】将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
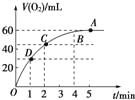
(1)实验时放出气体的总体积是 .
(2)放出一半气体所需的时间为 .
(3)反应放出![]() 体积气体所需的时间约为 .
体积气体所需的时间约为 .
(4)A,B,C,D各点反应速率的快慢顺序为
(5)解释反应速率变化的原因:
(6)计算H2O2初始状态的浓度 .
【答案】(1)60ml;
(2)1min;
(3)2min;
(4)D>C>B>A;
(5)随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小;
(6)0.11 molL﹣1.
【解析】
试题分析:(1)反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)反应放出气体体积为气体总体积的![]() 时,生成的气体体积为45mL,根据图象判断反应时间;
时,生成的气体体积为45mL,根据图象判断反应时间;
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(5)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;
(6)在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度.
解:(1)由反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60ml;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)生成的总体积为60mL,反应放出气体体积为气体总体积的![]() 时,生成的氧气体积为45mL,需要的时间为2min,
时,生成的氧气体积为45mL,需要的时间为2min,
故答案为:2min;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;
(5)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小,
故答案为:随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小;
(6)由反应方程式为:2H2O2![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2![]() 2H2O+O2↑
2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=![]() =0.00536mol,所以c(H2O2)=
=0.00536mol,所以c(H2O2)=![]() =0.11 molL﹣1,
=0.11 molL﹣1,
故答案为:0.11 molL﹣1.



