��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����һ��Ԫ�أ�NAΪ�����ӵ�������ֵ����

��1��Ԫ��Bλ��Ԫ�����ڱ��� ������s������p������d��������
��2����A��X��K����Ԫ���е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ�������� �������ʽ����
��3��ֻ��A��E��������Ԫ�صľ�����г����ԣ������ͳ��������һ��������ͼ��ʾ���þ���Ļ�ѧʽΪ ��

��4��Ԫ��D��K�γɵĻ������У�ÿ����������Χ�����������ȵ��������� �������û����ᄃ����ܶ�Ϊa g/cm3����������� cm3��
���𰸡���1��p����
��2��CCl4��PCl3��
��3��MgCNi3��
��4��12��![]() ��
��
���������������������Ԫ�����ڱ�֪��AΪ̼Ԫ�أ�BΪ��Ԫ�أ�DΪ��Ԫ�أ�E��þԪ�أ�FΪ��Ԫ�أ�XΪ��Ԫ�أ�KΪ��Ԫ�أ�MΪ��Ԫ�أ�
��1�����ݻ�̬ԭ�Ӻ�������Ų�ʽ����������������ȷ���������ƣ�
��2�������������������γɵĹ��ۼ����ж�8�����ȶ��ṹ��
��3�����þ�̯��ȷ�������Ļ�ѧʽ��
��4�������Ȼ��Ƶľ���ͼ�����������ܶȺ���������V=![]() ��
��
�⣺AΪ̼Ԫ�أ�BΪ��Ԫ�أ�DΪ��Ԫ�أ�E��þԪ�أ�FΪ��Ԫ�أ�XΪ��Ԫ�أ�KΪ��Ԫ�أ�MΪ��Ԫ�أ�
��1����ԭ�ӵĵ����Ų�ʽ��1s22s22p6��������p���ӣ�������ԭ��λ��p����
�ʴ�Ϊ��p����
��2����C��P��Cl�е�ij�����γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ��������CCl4��PCl3��
�ʴ�Ϊ��CCl4��PCl3��
��3��̼ԭ��λ�ڸþ����������ϣ����Ըþ����к���һ��̼ԭ�ӣ�þԭ�Ӹ���=8��![]() =1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6��
=1�����Ըþ�������1��þԭ�ӣ���ԭ�Ӹ���=6��![]() =3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3��
=3���þ����к���3����ԭ�ӣ����Ըþ����Ļ�ѧʽΪMgCNi3��
�ʴ�Ϊ��MgCNi3��
��4����֪�Ȼ��Ƶľ���ͼΪ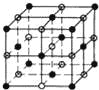 ��������ÿ��Na+��Χ�����������ȵ�Na+����12����
��������ÿ��Na+��Χ�����������ȵ�Na+����12����
�þ����������Ӹ���=1+12��![]() =4�������Ӹ���=8��
=4�������Ӹ���=8��![]() +6��
+6��![]() =4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V=
=4������1���Ȼ��ƾ����к���4���Ȼ��ƣ����������V=![]() =
=![]() cm3��
cm3��
�ʴ�Ϊ��12��![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����֪��1 mol������к���2 mol Si��Si������ҵ�Ͽ�ͨ�����з�Ӧ��ȡ�ߴ��裺SiCl4(g)��2H2(g)![]() Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
Si(s)��4HCl(g)�������±��оٵĻ�ѧ���ļ������ݣ��жϸ÷�Ӧ�ķ�Ӧ��(��H)Ϊ(����)
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
A����412 kJ��mol��1 B����412 kJ��mol��1
C����236 kJ��mol��1 D����236 kJ��mol��1