题目内容
【题目】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____B(选填“>或“<”);第一电离能N>O,原因是__________________________________________。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①![]() 的空间构型为_____________,其中硫原子采用____________杂化。
的空间构型为_____________,其中硫原子采用____________杂化。
②与![]() 互为等电子体的分子的化学式为_________________(任写一种即可)
互为等电子体的分子的化学式为_________________(任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。
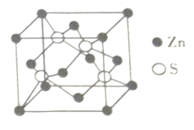
①与Zn原子距离最近的Zn原子有___________个。
②该化合物的化学式为_________________________________。
③已知该晶体的晶胞参数为a×10-12m,阿伏加德罗常数为NA。则该晶体的密度为__________________g/cm3(列式即可)
【答案】N 4 > N原子中2p轨道处于半充满状态,比较稳定,故第一电离能N>O 正四面体形 sp3 CCl4、SiCl4、SO2Cl2(任写一种即可) 12 ZnS ![]()
【解析】
(1)Zn位于周期表第四周期,基态Zn原子的核外电子,占据的能量最高的能层为第4层,符号为N;与Zn同位于第四周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有Sc、Ti、V、Mn四种,故答案为:N;4;
(2)同周期元素,从左至右,原子半径逐渐减小,原子核对外层电子的吸引力逐渐增强,电负性逐渐增强,所以电负性C>B;N的核外电子排布为[He]2s22p3,2p轨道处于半充满状态,比较稳定,O的核外电子排布为[He]2s22p4,不是稳定结构,所以第一电离能N>O,故答案为:>;N原子中2p轨道处于半充满状态,比较稳定,故第一电离能N>O;
(3)①SO42-的中心原子S的价层电子对数=4+![]() ×(8-4×2)=4,VSEPR模型为正四面体形,没有孤电子对,所以SO42-的空间构型为正四面体形,S原子的杂化方式为sp3,故答案为:正四面体形;sp3;
×(8-4×2)=4,VSEPR模型为正四面体形,没有孤电子对,所以SO42-的空间构型为正四面体形,S原子的杂化方式为sp3,故答案为:正四面体形;sp3;
②与SO42-互为等电子体的分子需满足:与SO42-原子总数相同(5个)、价电子总数相同(32个),如:CCl4、SiCl4、SO2Cl2等,故答案为:CCl4、SiCl4、SO2Cl2(任写一种即可);
(4)①Zn原子位于晶胞的顶点和面心上,与Zn原子距离最近的Zn原子有12个,故答案为:12;
②一个晶胞中Zn原子的个数=8×![]() +6×
+6×![]() =4,S原子的个数=4,二者的个数比为1:1,所以该化合物的化学式为ZnS,故答案为:ZnS;
=4,S原子的个数=4,二者的个数比为1:1,所以该化合物的化学式为ZnS,故答案为:ZnS;
③ =
= 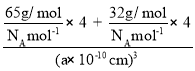 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。