题目内容
20.5g H2SO4的物质的量是多少?1.50mol Na2CO3的质量是多少?分析 已知M(H2SO4)=98g/mol,M(Na2CO3)=106g/mol,根据n=$\frac{m}{M}$计算相关物理量.
解答 解:n(H2SO4)=$\frac{5g}{98g/mol}$=0.051mol,
m(Na2CO3)=1.50mol×106g/mol=159g,
答:5g H2SO4的物质的量是0.051mol,1.50mol Na2CO3的质量是159g.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的计算能力以及基本概念的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
10.四种短周期元素在周期表中的位置如右图,其中只有M为金属元素,下列说法错误的是( )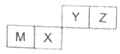

| A. | Y的气态氢化物与其最高价氧化物水化物能反应生成盐 | |
| B. | X的单质可做半导体和光电纤维材料 | |
| C. | M和Y的最高价氧化物对应水化物之间能相互反应 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定 |
11.下列物成中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 淀粉和葡萄糖 | C. | 蔗糖和麦芽糖 | D. | 果糖和蔗糖 |
8.如图立方烷(C8H8)的球棍模型,下列有关说法不正确的是( )
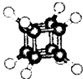

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
15.将等物质的量的X、Y气体充入固定容积的密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件建立新的平衡时,下表中关于新平衡与原平衡的比较正确的是 ( )
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
3.(1)在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
①根据上述数据判断,该可逆反应的正反应是放热(填“吸热”或“放热”)反应,理由是温度升高,平衡常数减小.
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
4.寻找新能源是解决温室效应的一条重要思路.磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
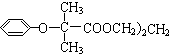
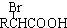 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$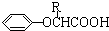
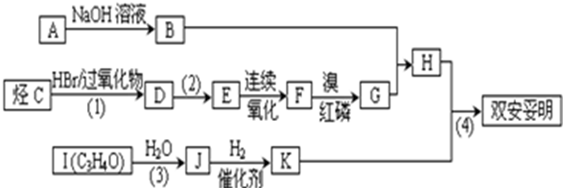
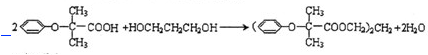
 .
.