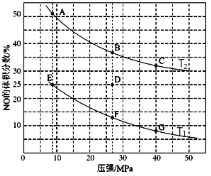
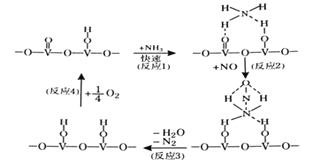
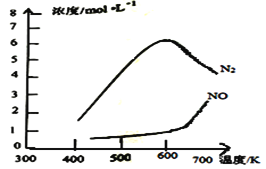
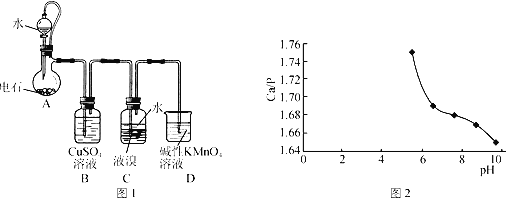
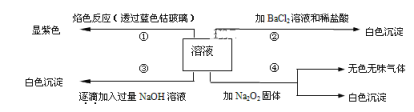
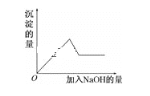
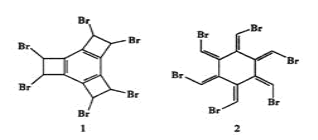
题目内容
【题目】(1)除去NaCO3粉末中混入的NaHCO3杂质用__________方法,化学方程式为____。
(2)除去氧化铜粉末中混入的氧化铝粉末通常用________试剂,离子方程式为________。
(3)通常用________试剂除去CO2中的HCl气体,离子方程式为________。
【答案】加热 2NaHCO3![]() Na2CO3+ CO2↑+H2O NaOH溶液 Al2O3+2OH-=2AlO2-+H2O 饱和NaHCO3溶液 HCO3-+ H+=CO2↑+H2O
Na2CO3+ CO2↑+H2O NaOH溶液 Al2O3+2OH-=2AlO2-+H2O 饱和NaHCO3溶液 HCO3-+ H+=CO2↑+H2O
【解析】
(1)NaHCO3受热易分解;
(2)氧化铝为两性氧化物,能溶于强碱溶液中;
(3)CO2与NaHCO3不反应,而HCl与NaHCO3可反应。
(1)NaHCO3受热易分解,因此除去NaCO3粉末中混入的NaHCO3杂质通常用加热的方法,方程式为:2NaHCO3![]() Na2CO3+ CO2 ↑+H2O;
Na2CO3+ CO2 ↑+H2O;
(2)向混合物中加入氢氧化钠溶液,其中杂质氧化铝可溶解,氧化铜不反应,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(3)将混合气体通入饱和NaHCO3溶液中,HCl与NaHCO3反应生成NaCl、水和CO2,而CO2与碳酸氢钠溶液不反应,因此可除去CO2中的HCl气体,离子反应为:HCO3-+H+=CO2↑+H2O。

【题目】下表是元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
(1)①—⑩中,最活泼的金属元素是___________________(写元素符号);最不活泼的元素是_______(写元素符号)。
(2)④、⑤的简单离子,其半径更大的是________(写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是_________(填化学式)。
(4)元素的非金属性:①_______⑦(填“>”或“<”)。
(5)①—⑨的最高价氧化物的水化物中:酸性最强的是___________(填化学式),既能与酸反应又能与碱反应的是___________(填化学式).