题目内容
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应为:
 ?
? (g)+H2(g)△H=a kJ?mol-1.
(g)+H2(g)△H=a kJ?mol-1.
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
 ?
? (g)+H2(g)△H=a kJ?mol-1.
(g)+H2(g)△H=a kJ?mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A、反应在前20min的平均速率为v(H2)=0.008mol?L-1?min-1 |
| B、保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol?L-1,则a<0 |
| C、保持其他条件不变,再向容器中充入0.40mol乙苯和0.40mol H2,平衡不移动 |
| D、达平衡状态的标志是气体密度不再变化 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,根据v=
计算v(乙苯),再根据速率之比等于化学计量数之比计算v(H2);
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,计算平衡时乙苯的浓度,根据升高温度乙苯的浓度变化,判断温度对平衡的影响,据此解答;
C.利用三段式平衡时各组分的平衡浓度,计算平衡常数,计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向,据此解答.
D.保持其他条件不变,容器中气体质量不变,容器体积不变,密度不变.
| ||
| △t |
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,计算平衡时乙苯的浓度,根据升高温度乙苯的浓度变化,判断温度对平衡的影响,据此解答;
C.利用三段式平衡时各组分的平衡浓度,计算平衡常数,计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向,据此解答.
D.保持其他条件不变,容器中气体质量不变,容器体积不变,密度不变.
解答:
解:A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)=
=0.004mol?L-1?min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004mol?L-1?min-1,故A错误;
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为
=0.1mol/L,升高温度乙苯的浓度变为0.08mol?L-1,说明平衡向正反应移动,正反应为吸热反应,故a>0,故B错误;
C.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为
=0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=
=0.1.相同温度下,起始时向容器中充入0.40mol乙苯和0.40molH2,此时苯乙烯浓度为0.1mol/L,此时浓度商Qc=
=0.1,等于平衡常数0.1,平衡不动,故C正确;
D.保持其他条件不变,容器中气体质量不变,容器体积不变,反应过程中和平衡状态下密度始终不变,不能说明反应达到平衡状态,故D错误;
故选C.
| ||
| 20min |
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为
| 0.4mol-0.2mol |
| 2L |
C.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为
| 0.2mol |
| 2l |
| 0.1×0.1 |
| 0.1 |
| ||
|
D.保持其他条件不变,容器中气体质量不变,容器体积不变,反应过程中和平衡状态下密度始终不变,不能说明反应达到平衡状态,故D错误;
故选C.
点评:本题考查化学反应速率计算、化学平衡有关计算、化学平衡常数计算与应用,难度中等,注意C选项中利用平衡常数判断反应进行方向.

练习册系列答案
相关题目
欲除去CuSO4?5H2O中的沙子(主要成分为SiO2),必要的实验操作为( )
| A、溶解 过滤 蒸发结晶 |
| B、加热 溶解 过滤 |
| C、溶解 过滤 蒸馏 |
| D、溶解 过滤 分液 |
在离子浓度都为0.1mol/L的下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确的是( )
| A、在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B、在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| C、在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
下列反应的离子方程式书写正确的是( )
| A、盐酸与氢氧化钠溶液反应:H++OH-═H2O |
| B、锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
| C、氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
| D、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
下列说法不正确的是( )
| A、胶体能发生电泳现象是因为胶体带电 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
| A、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B、NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
关于下列各装置图的叙述中,正确的是( )
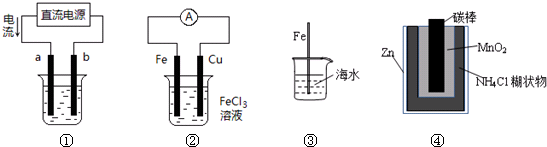

| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ |
| C、装置③中插入海水中的铁棒,越靠近底端腐蚀越严重 |
| D、装置④中Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
有温度、容积相同的甲、乙两个密闭容器.往甲容器中通入1g N2和1g H2,乙容器中通入2g N2和2g H2,保持恒温、恒容达到平衡,相关参数比较正确的是( )
| A、平衡时N2的转化率:α甲>2α乙 |
| B、平衡时NH3的浓度:2c甲<c乙 |
| C、平衡时体系压强:2p甲>p乙 |
| D、反应放出的热量:2Q甲>Q |
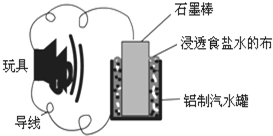 利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,如图就是一个用废旧材料制作的可用于驱动玩具的电池示意图.当电池工作时,有关说法正确的是( )| A、铝罐将逐渐被腐蚀 |
| B、石墨棒应与玩具电机的负极相连 |
| C、石墨棒上发生的反应为:O2+2H2O-4e-═4OH- |
| D、该电池工作一段时间后石墨棒的质量会减轻 |