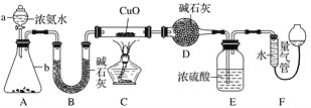
题目内容
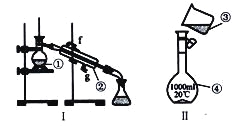
【题目】如图所示:
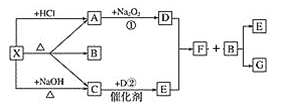
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)写出下列物质的化学式X_________,C_________,F_________,G__________。
(2)写出下列反应的化学方程式
①_____________________________________________。
②______________________________________________。
【答案】(NH4)2CO3(或NH4HCO3) NH3 NO2 HNO3 2Na2O2+2CO2=2Na2CO3+O2 4NH3+5O2 4NO+6H2O
4NO+6H2O
【解析】
X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与过氧化钠反应,故A为CO2,则X应为碳酸氢铵或碳酸铵,分解产物中B为H2O;反应①为CO2与Na2O2反应,且NH3能与反应①生成的产物之一发生催化氧化反应,则D为O2,反应②为NH3在O2中催化氧化生成的E为NO,NO和O2反应生成的F为NO2,NO2再与水反应生成HNO3和NO,则G为HNO3,再结合物质的性质进行解答。
X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与过氧化钠反应,故A为CO2,则X应为碳酸氢铵或碳酸铵,分解产物中B为H2O;反应①为CO2与Na2O2反应,且NH3能与反应①生成的产物之一发生催化氧化反应,则D为O2,反应②为NH3在O2中催化氧化生成的E为NO,NO和O2反应生成的F为NO2,NO2再与水反应生成HNO3和NO,则G为HNO3;
(1)由分析知:X为(NH4)2CO3(或NH4HCO3),C为NH3,F为NO2,G为HNO3;
(2) 反应①为CO2与Na2O2反应生成碳酸钠和氧气,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;反应②为氨气的催化氧化,发生反应的化学方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。

【题目】研究NOx、CO、SO2等大气污染气体的治理,对保护环境有重要的意义。回答下列问题:
(1)NOx与CO反应生成无污染气体的相关热化学方程式如下:
①NO2(g)+CO(g)![]() CO2(g)+NO(g) ΔH1=234.0kJ·mol1
CO2(g)+NO(g) ΔH1=234.0kJ·mol1
②4NO(g)![]() 2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
2NO2(g)+N2(g) ΔH2=291.8kJ·mol1
反应③2NO2(g)+4CO(g)![]() N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
N2(g)+4CO2(g)的ΔH3=___kJ·mol1,有利于提高该反应NO2平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g),测得相关数据如下:
N2(g)+4CO2(g),测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol·L1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将___(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是___。
A.CO的反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气的压强不再变化
③该温度下反应的化学平衡常数K=__(保留两位有效数字)。
④在20min时,保持温度不变,继续向容器中再加入2.0molNO2和2.0molN2,则化学平衡__移动(填“正向”、“逆向”或“不”)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。
①CH4还原NO2反应的化学方程式为___。
②在相同条件下,选用A、B、C三种不同催化剂进行反应,生成N2的物质的量与时间变化如图图1所示,其中活化能最大的是___[Ea(A)、Ea(B)、Ea(C)分别表示三种催化剂下该反应的活化能]。
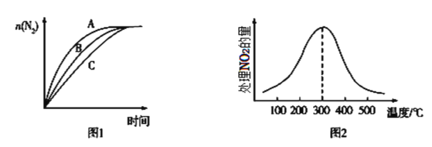
③在催化剂A作用下,测得相同时间内处理NO2的量与温度的关系如图2所示,曲线先增大后减小的可能原因是___。