题目内容
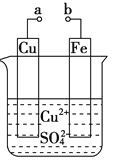
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
【答案】D
【解析】
0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
A、0~t1时,原电池的负极是Al片,故A正确;
B、0~t1时,硝酸根离子在正极得电子生成红棕色气体NO2,正极的电极反应式是NO3-+2H++e=NO2↑+H2O,故B正确;
C、t1后,铝发生钝化,铜作负极,所以,电池的正、负极发生互变,故C正确;
D、t1后,铜是负极,每有0.3 mol电子发生转移,就有0.15 mol铜失去电子,负极质量减少9.6 g,故D错误。
故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目