题目内容
5.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H5OH(l)反应生成C2H4(g)和H2O(l)的△H为( )| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
分析 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,根据盖斯定律 ②-③可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则三者的热化学方程式分别为:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,
故选A.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,注意掌握盖斯定律的含义及在反应热计算中的应用,明确热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 亚硫酸氢铵溶液中滴加少量NaOH溶液:NH4++OH-═NH3.H2O | |
| B. | 酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O═2I2+4OH- | |
| C. | 铜溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、F- | |
| C. | pH=7的溶液中:K+、CO32-、SO42-、Cl- | |
| D. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ |
20.下列氧化还原反应中,水作为还原剂的是( )
| A. | Cl2+H2?HCl+HClO | B. | Br2+SO2+2H2O=H2SO4+2HBr | ||
| C. | 2F2+2H2O=4HF+O2 | D. | CaO+H2O=Ca(OH)2 |
17.下列对化学概念判断的依据正确的是( )
| A. | 溶液与胶体:不同的本质原因是否发生丁达尔效应 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 氧化还原反应:元素化合价是否变化 | |
| D. | 电解质与非电解质:物质本身的导电性 |
14.以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况)( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
15.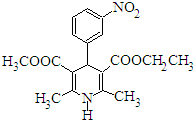 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )| A. | 该物质的分子式为C18H20N2O6 | |
| B. | 该物质可以和银氨溶液发生银镜反应 | |
| C. | 该物质属于芳香族化合物,能溶于水 | |
| D. | 该物质在酸性条件下不发生水解反应 |