题目内容
16.向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试卷中滴加氯水,振荡,CCl4层颜色逐渐变浅,最后变成无色,生成HIO3.(1)写出上述过程中发生反应的化学方程式:
①2KI+Cl2=2KCl+I2.
②I2+5Cl2+6H2O═2HIO3+10HCl.
(2)整个过程中的还原剂是KI、I2.
(3)把KI换成KBr,则CCl4层变为橙黄色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3.
(4)加碘盐中含碘量为20mg~50mg/kg.制取加碘盐(含KIO3的食盐)1000kg,若KI与Cl2反应制KIO3,至少需要消耗Cl2 10.58L(标准状况,保留2位小数).
分析 氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,结合反应的化学方程式解答该题.
解答 解:(1)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明氯气和KI发生置换反应生成碘单质,反应方程式为:2KI+Cl2=2KCl+I2,如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明碘和氯气发生氧化还原反应生成碘酸,氯气被还原生成HCl,反应方程式为I2+5Cl2+6H2O═2HIO3+10HCl,
故答案为:2KI+Cl2=2KCl+I2;I2+5Cl2+6H2O═2HIO3+10HCl;
(2)在反应2KI+Cl2=2KCl+I2中,I元素化合价升高,KI为还原剂,在Cl2+I2+H20→HIO3+HCl反应,I元素的化合价升高,被氧化,I2在反应中做还原剂,
故答案为:KI、I2;
(3)氯气的氧化性比溴强,将KI换成KBr,则生成Br2,继续滴加氯水,CCl4层的颜色没有变化,说明氧化性HBrO3>Cl2,根据氧化剂和还原剂反应生成氧化产物和还原产物,氧化剂氧化性大于氧化产物的氧化性,则有Cl2>HIO3,所以氧化性顺序为HBrO3>Cl2>HIO3,
故答案为:HBrO3>Cl2>HIO3;
(4)1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为:$\frac{20g}{127g/mol}$×3×22.4L/mol=10.58L.
故答案为:10.58.
点评 本题考查氯气的性质、氧化还原反应等知识点,侧重考查学生获取信息、加工信息的能力,根据题给信息确定发生的反应,根据元素化合价变化规律确定生成物,注意氯气和碘能发生氧化还原反应,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Na在空气中久置最终变为过氧化钠 | |
| B. | 金属钠着火后应立即用泡沫灭火器灭火 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2CO3叫纯碱,但属于盐类 |
| A. | 氧化还原反应的实质是化合价的升降 | |
| B. | 同温同压下,任何气体的分子间距离几乎相等 | |
| C. | 布朗运动是胶体区别于其他分散系的本质特征 | |
| D. | SO2的水溶液能够导电,所以SO2是电解质 |
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
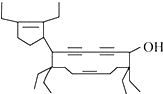 北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”.有一种有机物的键线式也酷似牛,如图所示,故称为牛式二烯炔醇.下列有关说法不正确的是( )
北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”.有一种有机物的键线式也酷似牛,如图所示,故称为牛式二烯炔醇.下列有关说法不正确的是( )| A. | 牛式二烯炔醇含有3种官能团 | |
| B. | 牛式二烯炔醇分子内能发生消去反应 | |
| C. | 1 mol牛式二烯炔醇最多可与6 molBr2发生加成反应 | |
| D. | 牛式二烯炔醇可发生取代反应 |
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
| A. | 干燥的 | B. | 以上三项均须要求的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 瓶塞不漏水的 |