题目内容
15.下列离子方程式正确的是( )| A. | 亚硫酸氢铵溶液中滴加少量NaOH溶液:NH4++OH-═NH3.H2O | |
| B. | 酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O═2I2+4OH- | |
| C. | 铜溶于稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
分析 A.强氧化钠少量先反应亚硫酸氢根离子;
B.酸性环境下不能生成氢氧根离子;
C.不符合反应客观事实,稀硝酸还原产物为一氧化氮;
D.NaHCO3溶液中加足量Ba(OH)2溶液反应生成碳酸钡、氢氧化钠和水.
解答 解:A.亚硫酸氢铵溶液中滴加少量NaOH溶液,离子方程式:HSO3-+OH-═SO32-++H2O,故A错误;
B.酸性KI淀粉溶液久置后变蓝,离子方程式:4I-+O2+24H+=2I2+2H2O,故B错误;
C.铜溶于稀硝酸中,离子方程式:C3u+8H++2NO3-═3Cu2++2NO↑+4H2O,故C错误;
D.NaHCO3溶液中加足量Ba(OH)2溶液,离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法即可解答,注意离子反应遵循客观事实、遵循原子个数守恒规律,题目难度不大.

练习册系列答案
相关题目
5.总压强为30Mpa时,氮气﹑氢气混合气体(体积比为1:3)通入合成塔,反应达平衡时,压强降为25Mpa则平衡时混合气体中氨气的体积分数为( )
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
6.下列关于钠及其化合物的叙述正确的是( )
| A. | Na在空气中久置最终变为过氧化钠 | |
| B. | 金属钠着火后应立即用泡沫灭火器灭火 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2CO3叫纯碱,但属于盐类 |
3. T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
法正确的是( )
 T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说
T℃下的溶液中,c(H+)=10-xmol•L-1,c(OH-)=10-ymol•L-1,x与y的关系如图所示.下列说法正确的是( )
| A. | T℃下,只有在纯水中才有c(H+)•c(OH-)=10-13 | |
| B. | 图中直线上的任意点都显中性 | |
| C. | T℃时,pH=7的溶液显碱性 | |
| D. | T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
10.下列化学用语表述不正确的是( )
| A. | HCl的电子式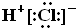 | B. | CH4的球棍模型: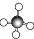 | ||
| C. | S2-的结构示意图为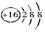 | D. | 乙烯的结构简式: |
20.H,D,T可以用来表示( )
| A. | 同一种原子 | B. | 化学性质不同的氢原子 | ||
| C. | 氢元素 | D. | 物理性质相同的氢原子 |
7.下列说法正确的是( )
| A. | 氧化还原反应的实质是化合价的升降 | |
| B. | 同温同压下,任何气体的分子间距离几乎相等 | |
| C. | 布朗运动是胶体区别于其他分散系的本质特征 | |
| D. | SO2的水溶液能够导电,所以SO2是电解质 |
4.下列离子方程式正确的是( )
| A. | 硫酸镁溶液跟氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
5.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H5OH(l)反应生成C2H4(g)和H2O(l)的△H为( )
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |