题目内容
20.下列氧化还原反应中,水作为还原剂的是( )| A. | Cl2+H2?HCl+HClO | B. | Br2+SO2+2H2O=H2SO4+2HBr | ||
| C. | 2F2+2H2O=4HF+O2 | D. | CaO+H2O=Ca(OH)2 |
分析 有电子转移的化学反应是氧化还原反应,水是还原剂,说明该反应中水中O元素的化合价升高,据此分析解答.
解答 解:A.Cl2+H2O=HCl+HClO,氯元素化合价由0价变为+1价和-1价,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故A不选;
B.Br2+SO2+2H2O=H2SO4+2HBr,Br、S元素化合价发生变化,水中H、O元素化合价不变,所以水既不是氧化剂也不是还原剂,故B错误;
C.2F2+2H2O=4HF+O2,该反应水中O元素化合价由-2价变为0价,所以水作还原剂,故C选;
D.CaO+H2O=Ca(OH)2,该反应中没有元素化合价变化,所以不是氧化还原反应,故D不选;
故选C.
点评 本题考查了氧化还原反应、氧化剂、还原剂的判断,明确基本概念内涵是解本题关键,根据元素化合价是否变化来分析解答,难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
10.下列化学用语表述不正确的是( )
| A. | HCl的电子式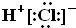 | B. | CH4的球棍模型: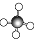 | ||
| C. | S2-的结构示意图为 | D. | 乙烯的结构简式: |
5.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ/mol、1411.0kJ/mol和1366.8kJ/mol,则由C2H5OH(l)反应生成C2H4(g)和H2O(l)的△H为( )
| A. | -44.2 kJ/mol | B. | +44.2 kJ/mol | C. | -330 kJ/mol | D. | +330 kJ/mol |
12.以下关于甲烷分子说法中错误的是( )
| A. | 甲烷分子是由非极性键构成的分子 | |
| B. | 甲烷分子具有正四面体结构 | |
| C. | 甲烷分子中四个C-H键是完全相同的键 | |
| D. | 甲烷分子和CCl4分子具有相同的空间结构 |
9.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. |  配制溶液 | B. | 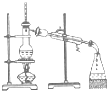 分离乙醇和水 | ||
| C. | 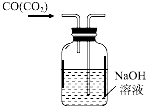 除去CO气体中的CO2 | D. | 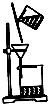 除去粗盐中的不溶物 |
10.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向某未知溶液中滴加几滴稀溴水 | 没有生成白色沉淀 | 溶液中一定不含苯酚 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | 分别加热Na2CO3和NaHCO3固体 试管内壁都有水珠 两种物质均受热分解 | |
| B. | 向某未知溶液中滴加几滴稀溴水 没有生成白色沉淀 溶液中一定不含苯酚 | |
| C. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 加入淀粉后溶液变成蓝色 氧化性:Cl2>I2 | |
| D. | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 加入H2O2后溶液变成血红色 Fe2+既有氧化性又有还原性 |