题目内容
【题目】硼及其化合物在工业上有许多用途。工业上用硼矿石![]() 主要成分为
主要成分为![]() ,还有少量MgO、
,还有少量MgO、![]() 等
等![]() 为原料制备粗硼的工艺流程如图所示。
为原料制备粗硼的工艺流程如图所示。

已知:①偏硼酸钠![]() 易溶于水,在碱性条件下稳定存在。②硼砂的化学式为
易溶于水,在碱性条件下稳定存在。②硼砂的化学式为![]() 。回答下列问题:
。回答下列问题:
(1)欲提高硼矿石的溶解速率,可采取的措施有______![]() 写出两条
写出两条![]() 。
。
(2)滤渣主要成分是______。
(3)硼砂中B的化合价为______,溶于热水后,常用![]() 调pH到2~3制取
调pH到2~3制取![]() ,反应的离子方程式为______。
,反应的离子方程式为______。
(4)![]() 为
为![]() 晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
(5)以硼酸为原料可制得硼氢化钠![]() ,它与水反应的离子方程式为
,它与水反应的离子方程式为![]() ,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______
,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______![]() 填“酸性”“中性”或“碱性“
填“酸性”“中性”或“碱性“![]() 条件下进行。
条件下进行。
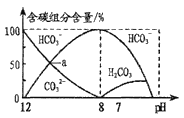
(6)硼酸熔点为![]() ,露置空气中无变化,加热至
,露置空气中无变化,加热至![]() 时失水而变成偏硼酸
时失水而变成偏硼酸![]() :
:![]() 。已知
。已知![]() 是弱酸,将等体积等物质的量浓度的
是弱酸,将等体积等物质的量浓度的![]() 与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
【答案】将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等 MgO、![]()
![]() B4O72+2H++5H2O=4H3BO3
B4O72+2H++5H2O=4H3BO3 ![]()
![]()
![]()
![]() 碱性
碱性 ![]()
【解析】
浓NaOH溶液溶解硼矿石![]() 主要成分为
主要成分为![]() ,还有少量MgO、
,还有少量MgO、![]() 等
等![]() ,MgO、
,MgO、![]() 不溶,
不溶,![]() 溶解生成
溶解生成![]() ,过滤,滤渣为MgO、
,过滤,滤渣为MgO、![]() ,滤液为
,滤液为![]() 溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用
溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用![]() 调pH到2~3制取
调pH到2~3制取![]() ,将得到的
,将得到的![]() 晶体加热脱水得到
晶体加热脱水得到![]() ,与Mg高温反应制得硼,据此解答。
,与Mg高温反应制得硼,据此解答。
(1)将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等都可以加快其溶解速率,故答案为:将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等;
(2)![]() 、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、
、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、![]() ,故答案为:MgO、
,故答案为:MgO、![]() ;
;
(3)硼砂![]() 中钠元素
中钠元素![]() 价,氧元素
价,氧元素![]() 价,化合物中元素化合价代数和为0,则B元素化合价为
价,化合物中元素化合价代数和为0,则B元素化合价为![]() 价;硼砂溶于热水后,常用
价;硼砂溶于热水后,常用![]() 调pH到2~3制取
调pH到2~3制取![]() ,反应的离子方程式为:B4O72+2H++5H2O=4H3BO3。故答案为:
,反应的离子方程式为:B4O72+2H++5H2O=4H3BO3。故答案为:![]() ;B4O72+2H++5H2O=4H3BO3;
;B4O72+2H++5H2O=4H3BO3;
(4)![]() 晶体加热脱水的产物X为
晶体加热脱水的产物X为![]() ,与Mg发生置换反应,反应为:
,与Mg发生置换反应,反应为:![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(5)因反应![]() 中,水中氢元素化合价降低,得到电子,则
中,水中氢元素化合价降低,得到电子,则![]() 为氧化剂;因
为氧化剂;因![]() 易与
易与![]() 结合,而碱性溶液可抑制它与水反应,故答案为:
结合,而碱性溶液可抑制它与水反应,故答案为:![]() ;碱性;
;碱性;
(6)将等体积等物质的量浓度的![]() 与NaOH溶液混合,恰好反应完得到
与NaOH溶液混合,恰好反应完得到![]() 溶液,
溶液,![]() 发生水解,
发生水解,![]() 减少,则
减少,则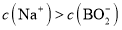 ,水解反应为:
,水解反应为:![]() ,溶液显碱性,则
,溶液显碱性,则![]() ,水解程度微弱,故
,水解程度微弱,故![]() ,故答案为:
,故答案为:![]() 。
。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
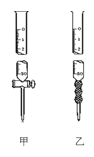
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
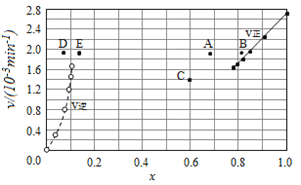
A. A D B. B D C. B E D. A E