题目内容
4.下列关于0.1mol/LNaHCO3溶液中微粒浓度的关系式正确的是( )| A. | c(CO32-)>c(H2CO3) | B. | c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=2[c(H2CO3)+c(HCO3)+c(CO32-)] | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
分析 NaHCO3是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(HCO3-),则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+);溶液中还存在物料守恒:c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),据此进行判断.
解答 解:A.常温下,NaHCO3是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,则c(CO32-)<c(H2CO3),故A错误;
B.NaHCO3是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(HCO3-),则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故B正确;
C.溶液中存在物料守恒,根据物料守恒得:c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),故C错误;
D.溶液呈存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D错误;
故选B.
点评 本题以盐类水解为载体考查了离子浓度大小比较,题目难度中等,根据盐的特点及碳酸氢根离子水解程度与电离程度的相对大小确定溶液酸碱性,再结合守恒思想分析解答.

练习册系列答案
相关题目
14.下列有关金属及其合金的说法不正确的是( )
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 低碳钢、中碳钢和高碳钢中的碳含量依次降低 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
15.下列说法正确的是( )
| A. | 苯酚和苯甲醇互为同系物 | |
| B. | 塑料、合成纤维、涂料被称为“三大合成材料” | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖 |
12.次氯酸可用于杀菌消毒.已知25°C时:[①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
9. 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )| A. | 放电时,电子由钙电极流出 | |
| B. | 放电过程中,Li+向PbSO4电极移动 | |
| C. | 每转移0.2mol电子,理论上生成20.7gPb | |
| D. | 负极反应式:PbSO4+2e-+2Li+═Li2SO4+Pb |
2.欲将蛋白质从水中析出而又不改变它的性质,可以加入( )
| A. | (NH4)2SO4溶液 | B. | 乙醇溶液 | C. | Pb(NO3)2溶液 | D. | NaOH溶液 |




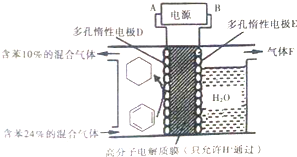 氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.
氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等. (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)