题目内容
9. 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )| A. | 放电时,电子由钙电极流出 | |
| B. | 放电过程中,Li+向PbSO4电极移动 | |
| C. | 每转移0.2mol电子,理论上生成20.7gPb | |
| D. | 负极反应式:PbSO4+2e-+2Li+═Li2SO4+Pb |
分析 由原电池总反应可知Ca为原电池的负极,被氧化生成反应H2(g)+Cl2(g)=2HCl(g),反应的电极方程式为Ca+2Cl--2e-=CaCl2,为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算.
解答 解:A.放电时,负极是钙,电子由负极流出,所以电子由钙电极流出,故A正确;
B.放电过程中阳离子向正极移动,故B正确;
C.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可知每转移0.2 mol电子,理论上生成0.1molPb,质量为20.7gPb,故C正确;
D.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故D错误;
故选D.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为D,注意把握原电池的构成条件,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某气态烃在密闭容器中与O2恰好完全反应,反应后恢复至原室温,测得压强为原来的50%,则该烃可能是( )
| A. | CH4 | B. | C3H4 | C. | C4H8 | D. | C2H4 |
17.下列反应中,属于吸热反应的是( )
| A. | Al与盐酸反应 | B. | 盐酸和NaOH溶液反应 | ||
| C. | 乙醇燃烧反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl固体反应 |
4.下列关于0.1mol/LNaHCO3溶液中微粒浓度的关系式正确的是( )
| A. | c(CO32-)>c(H2CO3) | B. | c(Na+)>c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=2[c(H2CO3)+c(HCO3)+c(CO32-)] | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
14.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图变化规律P表示压强,T表示温度,n表示物质的量):
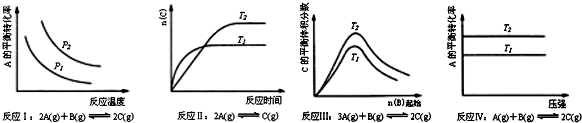
根据以上规律判断,上列结论正确的是( )

根据以上规律判断,上列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1<T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 反应Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |
1. 乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
 乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )| A. | a中所盛的固体可以是CuO | |
| B. | d中乙醇可用沸水浴加热 | |
| C. | c处具支试管b中有无色液体产生 | |
| D. | c处具支试管b可换成带塞的普通试管 |
8.下列现象或事实可用同一化学原理理解的是( )
| A. | 乙烯可使溴水和酸性高锰酸钾溶液褪色 | |
| B. | 双氧水和SO2均可使酸性高锰酸钾溶液褪色 | |
| C. | 浓硫酸和浓盐酸暴露在空气中浓度均减小 | |
| D. | 新制氯水和SO2均可使品红褪色 |
