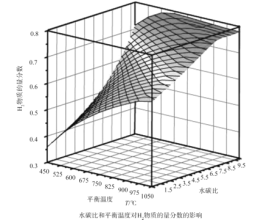
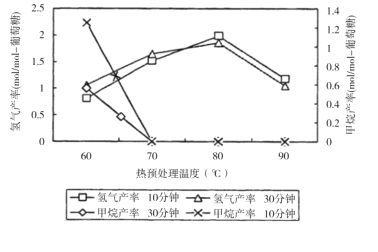
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.1mol N2含有的原子数目为NA
B.24gMg变为Mg2+时失去的电子数目为2NA
C.1 molL﹣1CaCl2溶液中含有的Cl﹣数目为2NA
D.常温常压下,11.2LCO2中含有的原子数目为1.5NA
【答案】B
【解析】
A.1mol N2含有的原子在常温常压下的数目为2NA,故A错误;
B.24gMg物质的量=![]() =1mol,变为Mg2+时失去的电子数目为2NA,故B正确;
=1mol,变为Mg2+时失去的电子数目为2NA,故B正确;
C.1 molL﹣1CaCl2溶液体积不知,不能计算溶液中含有的Cl﹣数目,故C错误;
D.常温常压下气体摩尔体积大于22.4L/mol,11.2LCO2中物质的量小于0.5mol,含有的原子数目小于1.5NA,故D错误;
故选:B。

【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)
【题目】按要求回答下列问题:
(1)现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
a. 以上物质中能导电的是________________________________。
b. 以上物质中属于电解质的是_______________________,属于非电解质的是_______________________。
c. 以上物质中,溶于水且能导电的物质是_______________________。
(2)胶体和溶液的本质区别是________________,鉴别胶体和溶液所采用的方法是观察是否能发生___________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O=4NaOH+ O2↑反应中,每消耗1 mol Na2O2生成_____ g O2。
②在NaHCO3的热分解反应中,每消耗168 g NaHCO3,标准状况下生成_____L CO2。
③Cl2+H2O=HCl+HClO反应中,标准状况下每消耗22.4LCl2,转移_____mol电子。
(4)在一个密闭容器中放入以下四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下:
物质 | M | N | Q | P |
反应前质量(g) | 50 | 1 | 3 | 12 |
反应后质量(g) | x | 26 | 3 | 30 |
①该变化的基本反应类型是_____反应;
②物质Q在反应中起的作用是_____。