题目内容
【题目】工业上利用软锰矿浆进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图所示(已知软锰矿的主要成分是MnO2,还含有Fe、A1、Mg、Zn、Ni、Si等元素)。

已知:Ksp[Mg(OH)2]=4.9×10-12,Kb(NH3·H2O)=1.8×10-5。
(1)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为______________________。
(2)向浸出液中添加适量MnO2的作用是_____________;滤渣2的主要成分是__________。
(3)“沉锰”的离子方程式为____________________________。
(4)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示。
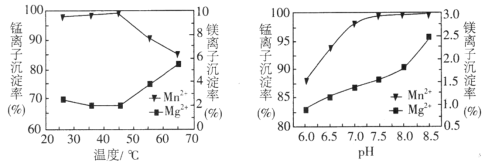
①由图可知,“沉锰”的合适条件是________________________。
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是___________________________。
(5)将NH3通入0.015mol·L-1MgSO4溶液中,使Mg2+恰好完全沉淀即溶液中c(Mg2+)=1.0×10-5mol·L-1,此时溶液中NH3·H2O的物质的量浓度为________________(忽略反应前后溶液体积的变化,计算结果保留2位小数)。
【答案】MnO2+SO2=MnSO4 将Fe2+氧化为Fe3 NiS和ZnS Mn2++HCO3-+NH3·H2O=MnCO3↓+NH4++H2O 45℃、pH=7.5 当温度高于45℃时,随着温度升高,NH4HCO3分解,c(![]() )下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 1.17mol·L-1
)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 1.17mol·L-1
【解析】
软锰矿的主要成分是MnO2,还含有Fe、A1、Mg、Zn、Ni、Si等元素,应均以金属氧化物的形式存在,SiO2、MnO2与硫酸不反应,硫酸酸化的软锰矿浆中含有Fe2+、A13+、Mg2+、Zn2+、Ni2+和SiO2、MnO2,通入含有SO2的烟气将二氧化硫吸收,二氧化硫与软锰矿浆中的MnO2作用生成生成Mn2+和SO42-,过滤后形成含有Mn2+、Fe2+、A13+、Mg2+、Zn2+、Ni2+、SO42-等的浸出液,二氧化硅不反应经过滤成为滤渣1,向浸出液中加入MnO2,将浸出液中的Fe2+氧化为Fe3+,加入氨水,调节pH值,使Fe3+、A13+形成Fe(OH)3、Al(OH)3沉淀除去,再向浸出液中加入硫化铵把Zn2+、Ni2+转化为NiS和ZnS沉淀除去,过滤后得到的滤渣2为NiS和ZnS,向过滤后的滤液中加入氨水和碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,向碳酸锰中加入硫酸得到硫酸锰,向含有Mg2+的溶液通入氨气,得到氢氧化镁,据此分析解答。
(1)“脱硫浸锰”中软锰矿浆中,MnO2与SO2反应生硫酸锰,化学方程式为MnO2+SO2=MnSO4;
(2)根据分析,向浸出液中添加适量MnO2的作用是将浸出液中的Fe2+氧化为Fe3+;滤渣2的主要成分是NiS和ZnS;
(3)根据分析,向过滤后的滤液中加入氨水和碳酸氢铵,得到碳酸锰和含有Mg2+的溶液,“沉锰”的离子方程式为Mn2++HCO3-+NH3H2O=MnCO3↓+ NH4++H2O;
(4)①由图可知,“沉锰”的合适条件是:温度控制在45℃左右, pH=7.5左右锰离子的沉淀率最高;
②当温度高于45℃时,Mn2+和Mg2+沉淀率变化的原因是:沉锰是要加入碳酸氢铵,铵盐受热易分解,当温度高于45℃时,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降;同时随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大;
(5) Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=4.9×10-12,c2(OH-)=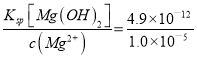 =4.9×10-7,c(OH-)=7×10-4mol·L-1,NH3通入0.015mol·L-1MgSO4溶液中,Mg2+恰好完全沉淀时生成硫酸铵,c(NH4+)= 2c(SO42-)=2×0.015 mol/L =0.03mol/L,一水合氨是弱电解质,电离方程式为:NH3·H2ONH4++OH-, Kb(NH3·H2O)=
=4.9×10-7,c(OH-)=7×10-4mol·L-1,NH3通入0.015mol·L-1MgSO4溶液中,Mg2+恰好完全沉淀时生成硫酸铵,c(NH4+)= 2c(SO42-)=2×0.015 mol/L =0.03mol/L,一水合氨是弱电解质,电离方程式为:NH3·H2ONH4++OH-, Kb(NH3·H2O)= =1.8×10-5,则NH3·H2O的物质的量浓度为
=1.8×10-5,则NH3·H2O的物质的量浓度为![]() =1.17mol/L。
=1.17mol/L。

 考前必练系列答案
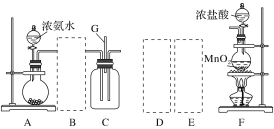
考前必练系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________