题目内容
6.在T℃时,硫化氢的水溶液中,存在以下平衡:H2S?HS-+H+、HS-?H++S2-,若使溶液的pH减小,则下列选项一定正确的是( )| A. | c(S2-)增大 | B. | c(HS-)减小 | ||
| C. | $\frac{c({H}^{+})•c(H{S}^{-})}{c({H}_{2}S)}$不变 | D. | c(H2S)减小 |
分析 若使溶液的pH减小,即氢离子浓度增大,升温、增大硫化氢浓度或加入盐酸,溶液的pH都会减小,弱电解质的电离平衡常数只受温度影响,据此分析.
解答 解:A、增大硫化氢浓度或加入盐酸,溶液的pH都会减小,增大硫化氢浓度时,c(S2-)增大,加入盐酸时,c(S2-)减小,故A错误;
B、增大硫化氢浓度时c(HS-)增大,故B错误;
C、弱电解质的电离平衡常数只受温度影响,温度不变其值不变,故C正确;
D、加入盐酸时,c(H2S)增大,故D错误;
故选C.
点评 本题考查了电离平衡移动的影响因素和溶液的pH变化,注意从影响弱电解质电离平衡移动的因素分析,题目难度不大.

练习册系列答案
相关题目
16.NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 常温常压下,48gO2跟48gO3 含有的氧原子数均为3NA | |
| B. | 1L 0.5mol/L的(NH4)2SO4溶液中含有NH4+数目为NA | |
| C. | 标准状况下,11.2L 氨气所含有的原子数是4NA | |
| D. | 80gNaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L |
17.下列说法正确的是( )
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 金属单质跟酸反应,一定放出氢气 | |
| C. | 元素从化合态变为游离态时,一定被氧化 | |
| D. | 元素从化合态变为游离态时,一定被还原 |
14.能在水溶液里大量共存,且加入强碱后无显著现象,再加入稀硫酸后既出现沉淀又逸出气体的离子组是( )
| A. | K+、Na+、Al3+、Br- | B. | Na+、K+、SiO32-、CO32- | ||
| C. | Ca2+、Mg2+、NO3-、Cl- | D. | K+、NH4+、AlO2-、Cl- |
11.下列有关化学与生活的叙述错误的是( )
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 采用纳米二氧化钛光触媒技术可将汽车尾气中的NO和CO转化为无害气体 |
18.下列结论正确的是( )
①离子还原性:S2->I->Fe2+>Br-
②氢化物沸点HF<HCl<HBr
③酸性:H2SO4>HClO4
④非金属性:F>Cl>S.
①离子还原性:S2->I->Fe2+>Br-
②氢化物沸点HF<HCl<HBr
③酸性:H2SO4>HClO4
④非金属性:F>Cl>S.
| A. | ②④ | B. | ①④ | C. | ①②③ | D. | 只有④ |
15.ZnC2、Al4C3、Mg2C3、Li2C2等与CaC2和H2O反应相似.下列说法不正确的是( )
| A. | C22-的电子式是[ ]2- ]2- | |
| B. | Mg2C3和Li2C2与水反应生成的烃可能具有相同的官能团 | |
| C. | 1mol ZnC2与水反应生成的烃的体积约为22.4L | |
| D. | Al4C3与水反应生成的烃分子中只有极性键 |
16.下列Cl2既表现氧化性又表现还原性的反应是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Cl2+H2O═HCl+HClO | ||
| C. | Cl2+Cu$\frac{\underline{\;点燃\;}}{\;}$CuCl2 | D. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
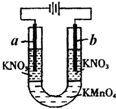 如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.
如图所示的实验可以证明KMnO4溶液的紫色是由于MnO4-离子存在的缘故,且不破坏MnO4-.U形管中加入KMnO4溶液,然后小心地在管端的两液面上加入KNO3溶液,将石墨电极插入KNO3溶液中,接通直流电源.