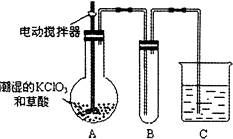
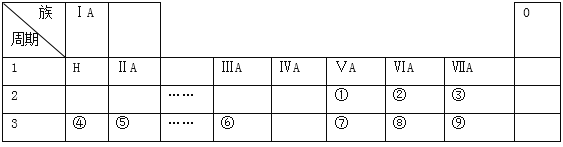
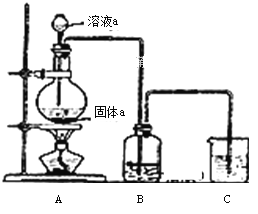
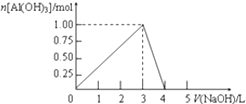
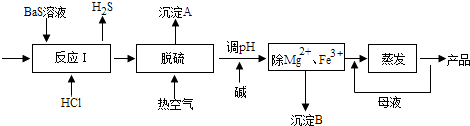
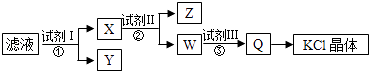
题目内容
【题目】已知:相对原子量:H -1,O-16,问:
① H2O的摩尔质量为:_________
② 36 g 水的物质的量为:_____________
③ 如果将这36 水完全电解生成H2和O2,则所得H2在标况下的体积约为:______
④ 1. 204×1024个H2O分子所含的氢原子数与_____ mol H2O2所含的氢原子数相等。
⑤ 1 mol Na2O2中所含阴离子数的个数约为:_________NA。
【答案】 18 g·mol -1 2 mol 44.8 L 2 1
【解析】①H2O的相对分子质量是18,摩尔质量为18 g·mol-1;②36 g 水的物质的量为36g÷18g/mol=2mol;③ 如果将这36 水完全电解生成H2和O2,所得H2的物质的量是2mol,在标况下的体积约为2mol×22.4L/mol=44.8L;④1.204×1024个H2O分子的物质的量是![]() ,所含的氢原子的物质的量是4mol,则与2 mol H2O2所含的氢原子数相等。⑤1 mol Na2O2中所含阴离子的物质的量是1mol,个数约为NA。
,所含的氢原子的物质的量是4mol,则与2 mol H2O2所含的氢原子数相等。⑤1 mol Na2O2中所含阴离子的物质的量是1mol,个数约为NA。

练习册系列答案
相关题目