题目内容
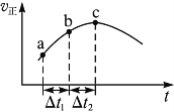
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
II.Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
[猜想假设] 黑色粉末X的组成可能是_________、_________,或二者的混合物。
[实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色。 |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(1)实验①中产生气泡的离子方程式为_________。
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:_________。
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如下图所示实验:
请根据数据分析说明黑色粉末X中是否含有Fe3O4。
_________。
【答案】 Fe、Fe3O4 Fe + 2H+ == Fe2+ + H2↑ Fe3O4 + 8H+ == 2Fe3+ + Fe2+ + 4H2O 、Fe + 2Fe3+ == 3Fe2+ 因为32 g Fe2O3 中含Fe元素为22.4 g,而25.6 g > 22.4 g,所以X中还含有O元素,还含有Fe3O4 因为产生4.48 L H2,需要Fe单质为11.2 g,而25.6 g > 11.2 g,所以X中还含有Fe3O4
【解析】[猜想假设] 根据题意,CO还原Fe2O3生成铁,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引,还可能生成Fe3O4,黑色粉末X可能是Fe、Fe3O4,或二者的混合物,故答案为:Fe、Fe3O4;
(1)黑色粉末X可能是Fe、Fe3O4,实验①中只有铁与盐酸反应有气泡放出,产生气泡的离子方程式为Fe + 2H+ == Fe2+ + H2↑ ,故答案为:Fe + 2H+ == Fe2+ + H2↑ ;
(2)①中四氧化三铁溶解生成的铁离子可能被铁还原为亚铁离子,导致遇KSCN溶液不变红色,因此不能推断黑色粉末X中无Fe3O4,故答案为:Fe3O4 + 8H+ == 2Fe3+ + Fe2+ + 4H2O 、Fe + 2Fe3+ == 3Fe2+;
(3)铁与盐酸反应生成氢气,氢气的物质的量=![]() =0.2mol,说明铁为0.2mol,质量为0.2mol×56g/mol=11.2g,而25.6 g > 11.2 g,所以X中还含有O元素,还含有Fe3O4,故答案为:因为产生4.48 L H2,需要Fe单质为11.2 g,而25.6 g > 11.2 g,所以X中还含有Fe3O4。
=0.2mol,说明铁为0.2mol,质量为0.2mol×56g/mol=11.2g,而25.6 g > 11.2 g,所以X中还含有O元素,还含有Fe3O4,故答案为:因为产生4.48 L H2,需要Fe单质为11.2 g,而25.6 g > 11.2 g,所以X中还含有Fe3O4。

【题目】用下图所示装置进行下列实验,a、b和c中所装试剂如下表所示,其中实验现象与结论对应关系正确的一组是
选项 | a | b | c | 现象 | 结论 |
A | 饱和食盐水 | 碳化钙 | 溴水 | c中溶液黄色褪去 | 乙炔发生还原反应 |
B | 浓盐酸 | KMnO4固体 | NaBr溶液 | c中溶液由无色变橙色 | Cl2的氧化性比Br2强 |
C | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 |
D | 硫酸 | Na2SO3固体 | 酸性KMnO4溶液 | c中溶液紫色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 )____min,原因是_________________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率________________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列__________以减慢反应速率。(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图。

①该反应的化学方程式是________。
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=(转化的物质的量/初始物质的量)×100%】,请写出计算过程,计算结果保留1位小数)________