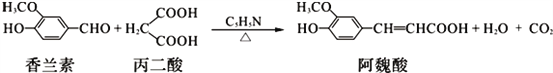
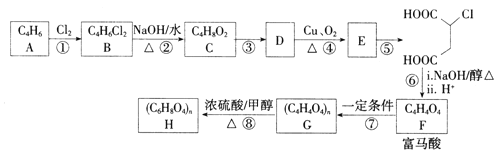
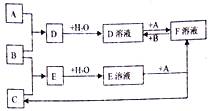
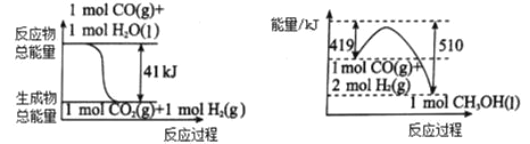
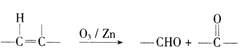��Ŀ����
����Ŀ��ͭ����������ɫ����ұ����������Ҫ����������Դ�����������������ʵ����Դ���ۺ����þ�����Ҫ���塣һ�ִ�ͭ�������з�����ȡ���ֽ���Ԫ�صĹ�����������:
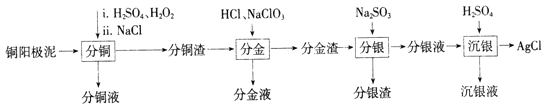
��֪:�ֽ�Һ����Ҫ�ɷ�Ϊ[AuCl4]-;�ֽ�������Ҫ�ɷ�ΪAgCl��PbSO4;����Һ����Ҫ�ɷ�Ϊ[Ag(SO3)2]3-���Ҵ���[Ag(SO3)2]3-![]() Ag++2SO32-��
Ag++2SO32-��
��1��������ͭ��ʱ,����ͭ������Ӧ�Ļ�ѧ����ʽΪ________����Ӧ������������ʵ��¶ȣ��¶Ȳ��˹�����͵�ԭ��Ϊ_______��
����֪����ͭ��ʱ ��Ԫ�صĽ��������±���ʾ��
Cu | Au | Ag | |
������/% | 85.7 | 0 | 4.5 |
����ͭ��ʱ����������NaCl����Ҫ����Ϊ__________
��2�����ֽ���ʱ,���ʽ�����Ӧ�����ӷ���ʽΪ___________��
��3����������ʱ����������������Һ��pH=4����֪: ![]() ,����X��ʾSO32-��HSO3-��H2SO3,��(x)��PH�Ĺ�ϵ��ͼ��ʾ��
,����X��ʾSO32-��HSO3-��H2SO3,��(x)��PH�Ĺ�ϵ��ͼ��ʾ��
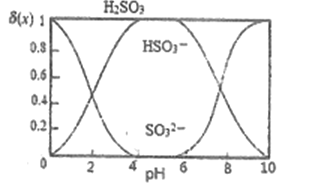
�ٷ����ܹ�����AgCl��ԭ��Ϊ_________
�ڵ�����Һ��PH���ܹ��ͣ�����Ϊ__________
��4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ�����ã�������ԭ��Ϊ____(�����ӷ���ʽ��ʾ)��
��5����֪����Ũ����10-5mol/Lʱ����Ϊ�����ӳ�����ȫ��Ksp[Pb(OH)2]=2.5��10-16.
Ksp[Sb(OH)3])=10-41. ��ȡ�����������ɵõ���0.025mol/L Pb2+����Һ( ������Sb3+����)������ýϴ�����Pb2+��Һ������PH�ķ�ΧΪ________�� (������Һ����仯)
���𰸡� Cu+H2O2+H2SO4=CuSO4+2H2O �¶ȹ�������Ӧ����̫��;�¶ȹ�����H2O2���ȷֽ� ʹ�ܽ����Ag+�γ�AgCl�����ͭ����������Ԫ�ص���ʧ 2Au+ClO3-+7Cl-+6H+=2[AuCl4]- H2SO4�������H+������SO32-��Ũ������ʹ[Ag(SO3)2]3![]() Ag++2SO32-ƽ�������ƶ��������Ag+��Ag+�����Һ�е�Cl-��Ӧ����AgCl ���������Ⱦ����SO2 HSO3-+OH-=SO32-+H2O 2��pH<7
Ag++2SO32-ƽ�������ƶ��������Ag+��Ag+�����Һ�е�Cl-��Ӧ����AgCl ���������Ⱦ����SO2 HSO3-+OH-=SO32-+H2O 2��pH<7
����������1��������ͭ��ʱ,����ͭ�ڹ������������������·�Ӧ��������ͭ��ˮ��������Ӧ�Ļ�ѧ����ʽΪCu��H2O2��H2SO4��CuSO4��2H2O����Ӧ������������ʵ��¶ȣ��¶Ȳ��˹�����ͣ��¶ȹ��ͣ���Ӧ����̫�����¶ȹ��ߣ�H2O2���ȷֽ⣻������ͭ��ʱ����������NaCl��ʹ�ܽ����Ag���γ�AgCl�����ͭ����������Ԫ�ص���ʧ����2�����ֽ���ʱ,���ʽ��������ƺ�������ת��Ϊ����������Ӧ�����ӷ���ʽΪ2Au��ClO![]() ��7Cl����6H����2[AuCl4]����3H2O����3����H2SO4�������H��������SO32����Ũ�ȣ���ʹ[Ag(SO3)2]3��
��7Cl����6H����2[AuCl4]����3H2O����3����H2SO4�������H��������SO32����Ũ�ȣ���ʹ[Ag(SO3)2]3��![]() Ag����2SO32��ƽ�������ƶ��������Ag����Ag�������Һ�е�Cl����Ӧ����AgCl���ڵ�����Һ��pH ���ܹ��ͣ����������Ⱦ����SO2����4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ������,������ԭ��ΪHSO
Ag����2SO32��ƽ�������ƶ��������Ag����Ag�������Һ�е�Cl����Ӧ����AgCl���ڵ�����Һ��pH ���ܹ��ͣ����������Ⱦ����SO2����4��������Һ���Ӽ����pH=8.0,Na2SO3��������ѭ������,������ԭ��ΪHSO![]() ��OH����SO32����H2O����5������ýϴ�����Pb2+��Һ����Pb2+��Ũ��Ϊ0.025mol/L��Ksp[Pb(OH)2]=c(Pb2+)c2(OH��)= 0.025mol/L
��OH����SO32����H2O����5������ýϴ�����Pb2+��Һ����Pb2+��Ũ��Ϊ0.025mol/L��Ksp[Pb(OH)2]=c(Pb2+)c2(OH��)= 0.025mol/L ![]() c2(OH��) =2.5��10-16����c(OH��) =1.0��10-7��pH<7��Sb3+������ȫ��Ksp[Sb(OH)3]= c(Sb3+)c3(OH��)= 10-5mol/L
c2(OH��) =2.5��10-16����c(OH��) =1.0��10-7��pH<7��Sb3+������ȫ��Ksp[Sb(OH)3]= c(Sb3+)c3(OH��)= 10-5mol/L ![]() c3(OH��)=10-41��c(OH��) =1.0��10-12��pH>2����ˣ�����ýϴ�����Pb2+��Һ,����PH�ķ�ΧΪ2<pH<7��
c3(OH��)=10-41��c(OH��) =1.0��10-12��pH>2����ˣ�����ýϴ�����Pb2+��Һ,����PH�ķ�ΧΪ2<pH<7��

����Ŀ��TiCl4�����Ѿ�����Ҫ�ɷ�ΪTiO2���Ʊ��ѣ�Ti������Ҫ�м����Ʊ���TiCl4������ʾ��ͼ���£�

���ϣ�TiCl4�����������Ȼ��������
������ | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
�е�/�� | 58 | 136 | 181�������� | 316 | 1412 |
�۵�/�� | 69 | 25 | 193 | 304 | 714 |
��TiCl4�е��ܽ��� | ���� | ���� | �� | ���� | |
��1���Ȼ����̣�TiO2��Cl2����ֱ�ӷ�Ӧ����̼����CO��CO2��ʹ��Ӧ���Խ��С�
��֪��TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) 2C(s)+O2(g)=2CO(g)
�� ����¯�м�̼�Ȼ�����TiCl4(g)��CO(g)�Ļ�ѧ����ʽ��________________
�� �Ȼ���Ӧ��β���봦�����ŷţ�β���е�HCl��Cl2�����տɵô����ᡢFeCl3��Һ����β��������Һ������_____________________��
�� �Ȼ�������ȴ�����£������˵õ���TiCl4���Һ���������к���_____________
��2�����ƹ��̣���TiCl4����������ô�TiCl4��ʾ��ͼ���£�
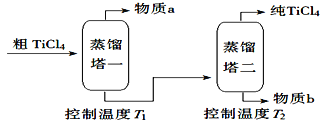
����a��_________��T2Ӧ������_________