题目内容
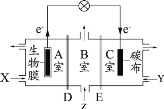
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O72-废水( pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中 D 和 E 为阳离子交换膜或阴离子交换膜,Z 为 待淡化食盐水。已知 Cr3+ 完全沉淀所需的 pH 为 5.6。下列说法不正确的是
A.C室的电极反应式为 ![]() +6e+8H+=2Cr(OH)3 ↓ + H2O
+6e+8H+=2Cr(OH)3 ↓ + H2O
B.X为有机物污水,Y为含![]() 废水
废水
C.理论上处理 1mol![]() 废水的同时可脱除 6mol的NaCl
废水的同时可脱除 6mol的NaCl
D.E为阴离子交换膜
【答案】D
【解析】
该装置为原电池装置,根据电子流向可知A室为负极,C室为正极,B室中待净化食盐水中氯离子需要流向负极,所以D为阴离子交换膜,钠离子需要流向正极,E为阳离子交换膜;![]() 转化为Cr(OH)3时需要被还原,所以应通入原电池的正极,则Y为含
转化为Cr(OH)3时需要被还原,所以应通入原电池的正极,则Y为含![]() 废水,X 为有机物污水。
废水,X 为有机物污水。
A.根据分析可知,C室通入含![]() 废水,得电子发生还原反应,结合电子守恒和电荷守恒可知方程式为
废水,得电子发生还原反应,结合电子守恒和电荷守恒可知方程式为![]() +6e+8H+=2Cr(OH)3 ↓ + H2O,故A正确;
+6e+8H+=2Cr(OH)3 ↓ + H2O,故A正确;
B.根据分析可知X为有机物污水,Y为含![]() 废水,故B正确;
废水,故B正确;
C.该原电池正极电极反应式为![]() +6e-+8H+=2Cr(OH)3↓+H2O,理论上处理1mol的
+6e-+8H+=2Cr(OH)3↓+H2O,理论上处理1mol的![]() 时转移电子6mol,则Na+、Cl-分别定向移动6mol,即可脱除6mol的NaCl,故C正确;
时转移电子6mol,则Na+、Cl-分别定向移动6mol,即可脱除6mol的NaCl,故C正确;
D.该原电池中碳电极为正极,放电时阳离子移向正极,阴离子移向负极,为了淡化食盐水,需要Na+移向C室,Cl-移向A室,所以E为阳离子交换膜,故D错误;
故答案为D。

【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大