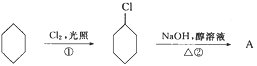
题目内容
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙=丁+己,甲+丙=戊+己;![]() 丁溶液的pH为13(25℃)。下列说法正确的是( )
丁溶液的pH为13(25℃)。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在元素周期表中的位置为第三周期第ⅣA族
C.![]() 甲与足量的乙完全反应共转移了
甲与足量的乙完全反应共转移了![]() 电子
电子
D.![]() 戊溶液中阴离子总的物质的量小于
戊溶液中阴离子总的物质的量小于![]()
【答案】C
【解析】
由“![]() 丁溶液的pH为13(25℃)” 可得丁化合物只可能是一元强碱,又知丁中的元素均为短周期元素,由“甲+乙=丁+己,甲+丙=戊+己”可知,丁是NaOH,甲是Na2O2,乙是水,丙是CO2,戊是Na2CO3,己是氧气。所以X是H、Y是C、Z是O、W是Na,据此回答。
丁溶液的pH为13(25℃)” 可得丁化合物只可能是一元强碱,又知丁中的元素均为短周期元素,由“甲+乙=丁+己,甲+丙=戊+己”可知,丁是NaOH,甲是Na2O2,乙是水,丙是CO2,戊是Na2CO3,己是氧气。所以X是H、Y是C、Z是O、W是Na,据此回答。
A. X是H、Y是C、Z是O 、W是Na,电子层数越多半径越大,同周期元素原子从左至右原子半径越来越小,所以半径大小顺序为:W>Y>Z>X,故A错误;
B. Y是C,C元素在元素周期表中的第二周期ⅣA,故B错误;
C. 甲是Na2O2,乙是水,根据化学方程式标电子转移: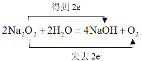 ,可知1mol Na2O2与足量的水完全反应生成NaOH转移了
,可知1mol Na2O2与足量的水完全反应生成NaOH转移了![]() 电子,故C正确;
电子,故C正确;
D. 戊是![]() ,
,![]() Na2CO3溶液水电离出的
Na2CO3溶液水电离出的![]()
![]() ,然后少量的
,然后少量的![]() 水解生成
水解生成![]() 和
和![]() ,使阴离子总的物质的量大于
,使阴离子总的物质的量大于![]() ,故D错误;
,故D错误;
故答案为C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目