题目内容
13.以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示: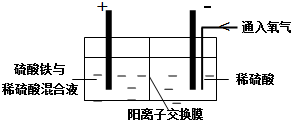
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解.在阴极区通入氧气,并加入少量催化剂.
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生.
Ⅳ.电解硫酸铜溶液制得金属铜.
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是吸收硫化氢气体,防止环境污染.
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是Fe2+在阳极放电Fe2+-e-=Fe3+,又生成Fe3+.
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解.写出上述现象对应的反应式2H++2e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O;.
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是分液漏斗;加入有机萃取剂的目的是富集Cu2+,分离Cu2+与其它金属阳离子.
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生.
(5)步骤Ⅳ,若电解200mL0.5mol/L的CuSO4溶液,生成铜3.2g,此时溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(Cu2+)>c(OH-).(忽略电解前后溶液体积的变化)
分析 (1)①硫化氢有毒,直接排放会污染空气;
②Fe3+被还原Fe2+,Fe2+在阳极放电又生成Fe3+;
(2)首先氢离子放电生成氢气,反应一段时间,铜离子放电生成铜,再通入氧气的条件下Cu、氧气、硫酸反应生成硫酸铜;
(3)有机相和水相不互溶,分离有机相和水相通常利用分液的方法,使用的仪器为分液漏斗;
加入有机萃取剂富集Cu2+,分离Cu2+与其它金属阳离子;
(4)增大氢离子浓度,根据平衡移动原理分析;
(5)电解uSO4溶液,发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,故生成H2SO40.1mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液中存在硫酸的电离、铜离子水解、水的电离等,据此判断.
解答 解:(1)①由发生的反应可知,Fe3+氧化吸收硫化氢气体,防止环境污染,
故答案为:吸收硫化氢气体,防止环境污染;
②Fe3+被还原Fe2+,Fe2+在阳极放电Fe2+-e-=Fe3+,又生成Fe3+,电解过程中,阳极区Fe3+的浓度基本保持不变,
故答案为:Fe2+在阳极放电Fe2+-e-=Fe3+,又生成Fe3+;
(2)首先氢离子放电生成氢气,反应一段时间,铜离子放电生成铜,再通入氧气的条件下Cu、氧气、硫酸反应生成硫酸铜,发生的反应依次为:2H++2 e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2H++2 e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O;
(3)有机相和水相不互溶,分离有机相和水相通常利用分液的方法,使用的仪器为分液漏斗;
加入有机萃取剂富集Cu2+,分离Cu2+与其它金属阳离子;
故答案为:分液漏斗;富集Cu2+,分离Cu2+与其它金属阳离子;
(4)向有机相中加入一定浓度的硫酸,增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生,
故答案为:增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)?R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
(5)电解uSO4溶液,发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为$\frac{3.2g}{64g/mol}$=0.05mol,故生成H2SO40.05mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液呈酸性,溶液中铜离子水解、水发生电离,故n(H+)>0.05mol×2=0.1mol,n(SO42-)=0.1mol,n(Cu2+)<0.05mol,溶液中氢氧根浓度很小,故c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-).
点评 本题考查电解原理、对工艺原理的理解、常用化学用语、离子浓度比较等,题目综合性较大,是对所学知识的综合考查,需要学生具有知识的基础与分析、解决问题的能力,难度中等,(5)中注意根据物质的量判断离子大小.

 阅读快车系列答案
阅读快车系列答案| A. | 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 | |
| B. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为$\frac{a}{2}$kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(l);△H1=-akJ•mol-1,则氢气燃烧热为akJ•mol-1 | |
| D. | N2(g)+3H2(g)=2NH3(g);△H=-akJ•mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
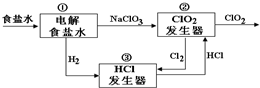 利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )
利用食盐水制取ClO2的工业流程如图所示,装置①中的反应:NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2↑;装置②中的反应:2NaClO3+4HCl$\frac{\underline{\;电解\;}}{\;}$ClO2+Cl2↑+2NaCl+2H2O.下列关于该流程说法不正确的是( )| A. | 该流程中Cl2、NaCl都可以循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
| A. | $\frac{1.5}{n}$ | B. | $\frac{n}{1.5}$ | C. | 1.5n | D. | $\frac{3}{n}$ |
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 增大压强会加快化学反应速率,其原因是增加了活化分子的百分率 | |
| D. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| A | B | C | D | |
| 弱电解质 | HCl | CH3COOH | HClO | Ca(OH)2 |
| 强电解质 | H3PO4 | FeCl3 | BaSO4 | HNO3 |
| 非电解质 | CH4 | Cu | C2H5OH | H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 过滤是根据物质颗粒大小的差别来分离或提纯物质的一种方法 | |
| B. | 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 | |
| C. | 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 | |
| D. | 不慎将油汤洒在衣服上可用酒精、汽油除去 |
| A. | 摩尔只适用于微观粒子,它是国际七个基本物理量之一 | |
| B. | 在同温同压下,气体体积的大小主要由气体分子数决定 | |
| C. | 二氧化碳的摩尔质量为44g | |
| D. | 0.5mol的Mg与足量的盐酸反应转移电子数为3.01×1023 |
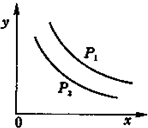 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )| A. | a>b | B. | 上述反应是吸热反应 | ||
| C. | 升温K减小 | D. | 加压K增大 |