题目内容
18.下列物质分类组合正确的是( )| A | B | C | D | |
| 弱电解质 | HCl | CH3COOH | HClO | Ca(OH)2 |
| 强电解质 | H3PO4 | FeCl3 | BaSO4 | HNO3 |
| 非电解质 | CH4 | Cu | C2H5OH | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在水溶液里和熔融状态下都不导电的化合物;单质、混合物既不是电解质也不是非电解质;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中或熔融状态下能部分电离的电解质,包括弱酸、弱碱、水.
解答 解:A.HCl、H3PO4、CH4,分别是强电解质、弱电解质、非电解质,故A错误;
B.CH3COOH、FeCl3、Cu,分别是弱电解质、强电解质,铜既不是电解质也不是非电解质,故B错误;
C.HClO、BaSO4、C2H5OH,分别是弱电解质、强电解质、非电解质,故C正确;
D.Ca(OH)2、HNO3、H2O,分别是强电解质、强电解质、弱电解质,故D错误;
故选:C.
点评 本题主要考查电解质、非电解质、强电解质、弱电解质的判断,注意电解质和非电解质都必须是化合物,溶液的导电能力与溶液中的离子浓度有关,与电解质的强弱无关,强电解质必须能完全电离,题目较简单.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
8.已知EA、EB、EC、ED分别表示A、B、C、D所具有的能量,则对于放热反应A+B═C+D,以下说法正确的是( )
| A. | EA>EB | B. | EA>EC+ED | C. | EA+EB>EC+ED | D. | EA+EB<EC+ED |
9.下列物质在生活中应用时,起还原作用的是( )
| A. | 铁粉作食品袋内的脱氧剂 | B. | 用生石灰做干燥剂 | ||
| C. | 漂粉精作消毒剂 | D. | 明矾作净水剂 |
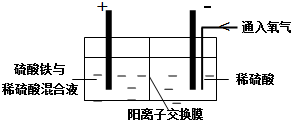
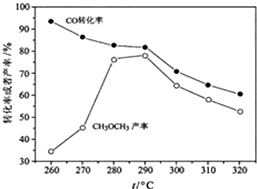 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应: