题目内容
3.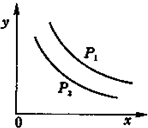 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图1所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,K表示该反应平衡常数.据此可判断( )| A. | a>b | B. | 上述反应是吸热反应 | ||
| C. | 升温K减小 | D. | 加压K增大 |
分析 由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应;增大压强,G的体积分数增大,则平衡向生成G的方向移动,说明a<b.
解答 解:由图象曲线的变化特点可知,升高温度,G的体积分数减小,说明升高温度平衡向正反应方向移动,说明该反应的正方向为吸热反应;增大压强,G的体积分数增大,则平衡向生成G的方向移动,说明a<b,所以A错误,B正确,又平衡常数仅与温度有关,升高温度平衡向正反应方向移动,则升温K增大,加压K不变,所以CD错误,
故选B.
点评 本题考查化学平衡移动,难度不大.注意分析曲线变化特点,从温度和压强的变化的趋势进行分析判断.

练习册系列答案
相关题目
14.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅 $→_{高温}^{Cl_{2}}$ SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$ Mg、 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | AgNO3(aq) $\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq) $→_{△}^{蔗糖}$ Ag |
11.下列方法能达到实验要求的是( )
| A. | 用100mL量筒取5.0mL稀硫酸 | |
| B. | 用托盘天平准确称取2.50gNaCl固体 | |
| C. | 实验室制取蒸馏水的装置中,温度计水银球应插入蒸馏烧瓶液面以下 | |
| D. | 配制240mL0.1mol/LNaOH溶液应该选择250mL的容量瓶 |
18.下列反应无颜色变化的是( )
| A. | 草酸溶液中逐滴加入高锰酸钾溶液 | |
| B. | 铬酸钾溶液中逐滴加入浓硫酸 | |
| C. | 硫代硫酸钠溶液与稀硫酸混合,充分反应 | |
| D. | 硫酸亚铁溶液中滴加硫氰化钾溶液 |
12.下列热化学方程式的书写正确的是( )
| A. | 1mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 101 kPa下,26 g乙炔在足量氧气中完全燃烧生成液态水,放出1 299.6 kJ的热量:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 299.6 kJ | |
| C. | 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| D. | 1 mol B2H6气体完全燃烧生成固态三氧化二硼和液态水,放出2 165 kJ的热量:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2 165 kJ•mol-1 |
13.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1 L 0.1 mol L-1NaHCO3溶液含有0.1NA个HCO3- | |
| B. | 1L0.1mol•L-1乙酸溶液电离的H+数为0.1NA | |
| C. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2 NA | |
| D. | 标准状况下,22.4L溴苯的分子数为NA |
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应: