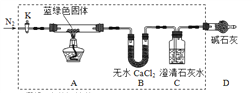
题目内容
【题目】某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=﹣lg[OH﹣])与pH的变化关系如图所示,则( ) 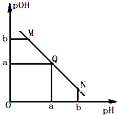
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO﹣)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】C
【解析】解:A.由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,故A错误; B.N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO﹣),故B错误;
C.由于M点的H+浓度等于N点的OH﹣浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故C正确;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故D错误.
故选C.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2Fe2++I2的是
2Fe2++I2的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和③ B. ②和④ C. ③和④ D. ①和②
【题目】在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是( )
时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3 mol/(Lmin)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3 mol/L
C.若起始时只充入0.60 mol Z(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60 mol X(g)、0.10 mol Y(g)和0.50 mol Z(g),达到平衡前v(正)>v(逆)
【题目】取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
固体组成 | NaI、NaBr、NaCl | NaBr、NaCl | NaCl | ||
氯气的体积/ml | V | 2V | 3V | 4V | 5V |
固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
求:(1)请填写表中空白______________、____________;
(2)标准状况下氯气的体积V为_______,原混合物中溴化钠的物质的量为_______。