题目内容
【题目】取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
固体组成 | NaI、NaBr、NaCl | NaBr、NaCl | NaCl | ||
氯气的体积/ml | V | 2V | 3V | 4V | 5V |
固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
求:(1)请填写表中空白______________、____________;
(2)标准状况下氯气的体积V为_______,原混合物中溴化钠的物质的量为_______。
【答案】 乙:NaI、NaBr、NaCl 丁: NaBr、NaCl 1344 1mol
【解析】戊中固体NaCl质量29.25g,根据钠离子守恒得n(NaBr)+n(NaI)+n(NaCl)=![]() =0.5mol,由钠离子守恒可知反应后蒸干灼烧得到的固体的物质的量不变为0.5mol,
=0.5mol,由钠离子守恒可知反应后蒸干灼烧得到的固体的物质的量不变为0.5mol,
将反应甲至戊视作每次增加vml氯气计算,因还原性I->Br->Cl-,故先有2NaI+Cl2=2NaCl+I2…①,反应完后再有2NaBr+Cl2=2NaCl+Br2…②;
(1)对于乙视作甲增加vml氯气,导致固体质量减少为54.62g-43.64g=10.98g,因还原性I->Br->Cl-,故先有2NaI+Cl2=2NaCl+I2,反应完后再有2NaBr+Cl2=2NaCl+Br2。
vmL氯气与NaI反应导致固体质量减少最多
2NaI+Cl2=2NaCl+I2 固体减少
1mol 254g-71g=183g
0.06mol a
所以a=10.98g,等于甲通入vml氯气导致固体质量减少,所以乙最后通入vml氯气只与NaI反应,对于丙视作乙增加vmL氯气,导致固体质量减少为43.64g-35.48=8.16g,vmL氯气与NaBr反应导致固体质量减少最少为35.48g-30.14g=5.34g,小于8.16g,故丙中最后vmL氯气,既与NaI反应又与NaBr反应。由上述分析可得:固体乙的组成为NaI、NaBr、NaCl;对于戊视作丁增加vmL氯气,蒸干灼烧得到固体的质量还在减少,结合丙固体的组成为NaBr、NaCl,说明丁固体的组成为NaBr、NaCl;(2)丁中最后vmL氯气与NaBr反应,vmL氯气完全反应,且有NaBr剩余,令vmL氯气的物质的量为n,则
Cl2+2NaBr=2NaCl+Br2 固体减少
1mol 160g-71g=89g
n 35.48g-30.14g=5.34g
所以n=0.06mol,即vml氯气的物质的量为0.06mol,标准状况下体积为0.06mol×22.4L/mol=1.344L=1344mL;由于乙最后通入vmL氯气只与NaI反应,甲通入vmL氯气导致固体质量减少等于乙最后通入vmL氯气导致固体质量减少,所以原溶液中NaI与NaBr的总质量为54.62g+10.98g=65.6g,令原溶液中NaI的物质的量为xmol,NaBr的物质的量为ymol,则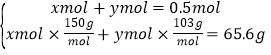 ,解得x=0.3,y=0.2,则原来混合物中溴化钠的物质的量=0.2mol×5=1mol。
,解得x=0.3,y=0.2,则原来混合物中溴化钠的物质的量=0.2mol×5=1mol。

 阅读快车系列答案
阅读快车系列答案