题目内容
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
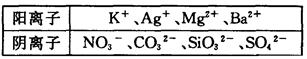
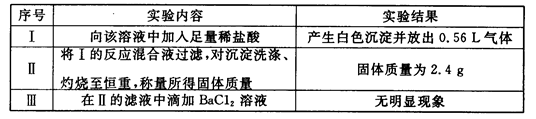
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是____________。
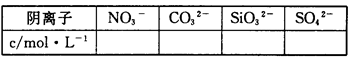
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_____________。
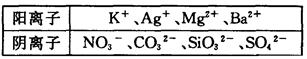
取该溶液100mL进行如下实验(气体体积在标准状况下测定):

试回答下列问题:
(1)实验Ⅰ能确定一定不存在的阳离子是____________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)

(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_____________。
(1)Ag+、Mg2+、 Ba2+ (2)c(NO3-)=?c(CO32-)="0.25mol/L" c(SiO32-)="0.4mol/L" c(SO42-)=0mol/L
(3)存在,其最小浓度为0.8mol/L
(3)存在,其最小浓度为0.8mol/L
试题分析:(1)加入盐酸产生气体,说明含有CO32-。n(CO32-)="0.56÷22.4=0.025mol" c(CO32-)="0.25mol/L" n(Na)=0.1L×0.5mol/L=0.05mol=2n(CO32-).∵CO32-和Ag+、Ba2+、 Mg2+会发生沉淀反应而不能大量共存,加入盐酸产生沉淀应该是SiO32-与氢离子发生沉淀反应:2H++SiO32-=H2SiO3↓。结合电荷守恒可知不含有Ag+、Mg2+、 Ba2+。(2)H2SiO3
 H2O+SiO2.n(SiO2)="2.4g÷60g/mol=0.04mol." n((SiO32-)= n(SiO2)= 0.04mol.;c(SiO32-)=0.4mol/L.向溶液中加入BaCl2无沉淀说明不含硫酸根离子。c(SO42-)=0mol/L根据实验不能确定NO3-是否存在。(3)根据溶液电中性原理溶液一定含有K+离子。若不存在NO3-。则n(K+)="2" n((SiO32-)="0.08mol,C(K+)=0.8" mol/L.若存在NO3-则C(K+)>0.8 mol/L。
H2O+SiO2.n(SiO2)="2.4g÷60g/mol=0.04mol." n((SiO32-)= n(SiO2)= 0.04mol.;c(SiO32-)=0.4mol/L.向溶液中加入BaCl2无沉淀说明不含硫酸根离子。c(SO42-)=0mol/L根据实验不能确定NO3-是否存在。(3)根据溶液电中性原理溶液一定含有K+离子。若不存在NO3-。则n(K+)="2" n((SiO32-)="0.08mol,C(K+)=0.8" mol/L.若存在NO3-则C(K+)>0.8 mol/L。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Mg2+ (aq) + 2OH- (aq)向溶解方向移动
Mg2+ (aq) + 2OH- (aq)向溶解方向移动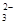 、NO3-、Na+、S2-、AlO2-、SO32-;
、NO3-、Na+、S2-、AlO2-、SO32-;