题目内容
1.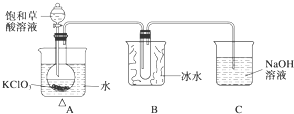 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃.
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.
(1)写出制备ClO2的化学方程式:
KClO3+1H2C2O4═2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请将实验步骤以及预期现象和结论填入下表.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-1 HCl溶液、0.01mol•L-1 KMnO4溶液、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
分析 (1)根据质量守恒和得失电子守恒配平方程式;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2分析,ClO2沸点较低,易液化;
(3)草酸可与生成物碳酸氢钾反应生成二氧化碳,或KClO3氧化草酸生成二氧化碳气体;
(4)①沉淀可能为CaCO3或CaC2O4或二者都有;
②利用盐酸和碳酸钙反应生成二氧化碳气体能使澄清石灰水变浑浊验证碳酸钙的存在,加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证草酸钙的存在.
解答 解:(1)由质量守恒和得失电子守恒可配平,方程式为2KClO3+H2C2O4=2KHCO3+2ClO2↑,故答案为:2;1;2;2;
(2)反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2,需要温度计控制温度,A装置中还缺少的一样仪器名称是为温度计,ClO2的沸点较低,易液化,B可起到冷凝收集的作用,
故答案为:温度计;将ClO2冷凝收集;
(3)反应后生成KHCO3,过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O,
也可能为因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3,
故答案为:过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3;
(4)①沉淀可能为CaCO3或CaC2O4或二者都有,故答案为:只存在CaC2O4;
②进行实验先检验碳酸钙的存在,再利用加入的酸溶解生成的草酸和高锰酸钾溶液反应使溶液褪色来设计实验进行验证,取少量沉淀于试管中,加入足量1 mol•L-1 HCl,将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,说明菠菜中含有碳酸盐,向步骤1得到的溶液中滴加几滴0.01 mol•L-1 KMnO4溶液紫红色褪去,说明菠菜中含有草酸盐,
故答案为:
| 实验步骤 | 预期现象和结论 |
| 足量0.1 mol•L-1 HCl | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
| 往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
点评 本题考查了物质性质的实验设计和实验分析判断,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,掌握实验基础和物质性质是解题关键,题目难度中等.

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案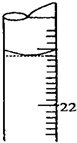 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶
液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如下表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 如图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,
则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
| A. | 调味剂 | B. | 防腐剂 | C. | 增稠剂 | D. | 着色剂 |
| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
 温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )
温度为t℃时,在10mL1.0mol/L的盐酸中,逐滴滴入xmol/L的氨水,随着氨水遂渐加入,溶液中的温度变化曲线(曲线I)和pH变化曲线(曲线II)如图所示(忽略混合时溶液体积的变化).下列有关判断正确的是( )| A. | c点时,c(NH3•H2O)=1.0mol•L-1 | B. | a点时,水的电离程度最大 | ||
| C. | b点时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) | D. | c点时,c(NH3•H2O)=$\frac{x-1}{2}$mol•L-1 |
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题: ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同. .
.