题目内容
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。

(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:

①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
【答案】A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 ![]() %
%
【解析】
(1)由二氧化锰与浓盐酸加热(或高锰酸钾与浓盐酸)制备氯气,根据反应条件选择可得;
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,据此分析可得;
(3)X制备NO气体,Y干燥NO气体,干燥的NO与氯气在Z中反应,
①X装置的优点是可以排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气;
(4)已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,利用Ag2CrO4为砖红色沉淀来指示反应达到终点,氯元素守恒:ClNO~HCl~AgNO3,结合化学方程式定量关系计算亚硝酞氯(ClNO)的质量分数。
(1)制取氯气可以用二氧化锰与浓盐酸加热或高锰酸钾与浓盐酸反应制得,选择A,发生的离子反应为:MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl
Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,为保证除杂彻底,导气管均长进短出,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,故导气管连接顺序为a→f→g→c→b→d→e→j→h,装置F→D→E→G,故答案为:F;D;E;G;
(3)①用B装置制备NO,与之相比X装置可以排除装置内空气的干扰;可以随开随用,随关随停,故答案为:排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气,故答案为:排干净三颈瓶中的空气;
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点,
根据氯元素守恒:ClNOHClAgNO3,
11
ncmol/L×20.00×103L×![]()
n=cmol/L×20.00×103L×![]() =c×20.00×103×10mol=0.2c mol,
=c×20.00×103×10mol=0.2c mol,
亚硝酞氯(ClNO)的质量分数=![]() ×100%=
×100%=![]() %,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;
%,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;![]() %。
%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室用图所示装置制备KClO溶液,并通过KClO溶液与![]() 溶液的反应制备高效水处理剂
溶液的反应制备高效水处理剂![]() 已知
已知![]() 具有下列性质
具有下列性质![]() 可溶于水、微溶于浓KOH溶液,
可溶于水、微溶于浓KOH溶液,![]() 在
在![]() 、强碱性溶液中比较稳定,
、强碱性溶液中比较稳定,![]() 在
在![]() 和
和![]() 催化作用下发生分解,
催化作用下发生分解,![]() 在酸性至弱碱性条件下,能与水反应生成
在酸性至弱碱性条件下,能与水反应生成![]() 和
和![]() 。
。
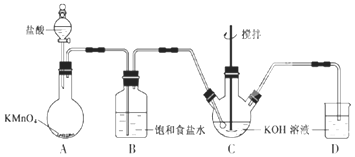
(1)装置A中![]() 与盐酸反应生成
与盐酸反应生成![]() 和
和![]() ,其化学方程式为______,装置B的作用是______。
,其化学方程式为______,装置B的作用是______。
(2)![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,试写出该反应的离子方程式______。
,试写出该反应的离子方程式______。
(3)制备![]() 时,KClO饱和溶液与
时,KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
(4)已知![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 下表列出了几种离子生成氢氧化物沉淀的
下表列出了几种离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
开始沉淀的pH | 沉淀完全的pH | |
|
|
|
|
|
|
|
|
|
实验中可选用的试剂:![]() 、
、![]() 、
、![]() 由某硫酸锌溶液
由某硫酸锌溶液![]() 含
含![]() 、
、![]() 杂质
杂质![]() 制备ZnO的实验步骤依次为:
制备ZnO的实验步骤依次为:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。
【题目】资料显示“![]() 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究![]() 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。

供选试剂:![]() 溶液、
溶液、![]() 固体、
固体、![]() 固体。
固体。
该小组同学设计![]() 、
、![]() 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 向Ⅰ试管中加入 Ⅱ试管中加入适量 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用![]() 固体制取
固体制取![]() ,为避免
,为避免![]() 固体随
固体随![]() 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________,![]() 组实验中
组实验中![]() 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比![]() 、
、![]() 两组实验可知,
两组实验可知,![]() 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与![]() 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | 溶液略变蓝 |
| 向Ⅰ试管中加入 | 无明显变化 |
对于实验![]() 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“![]() 时
时![]() 不能氧化
不能氧化![]() ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
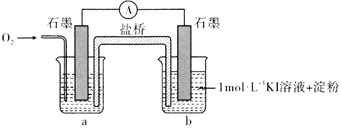
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入![]() 后________。
后________。
(iii)小刚同学向![]() 的KOH溶液
的KOH溶液![]() 含淀粉
含淀粉![]() 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有![]() ,褪色的原因是________
,褪色的原因是________![]() 用离子方程式表示
用离子方程式表示![]() 。
。
(4)该小组同学对实验过程进行了反思:实验![]() 的现象产生的原因可能是________。
的现象产生的原因可能是________。