题目内容
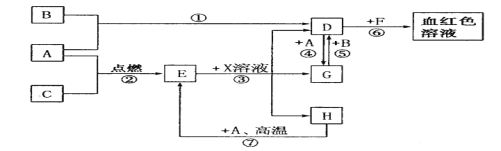
【题目】已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色;B、D为液体,D的浓溶液在常温下能使铁钝化;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,B分子中有18个电子。(反应中部分生成物已略去)
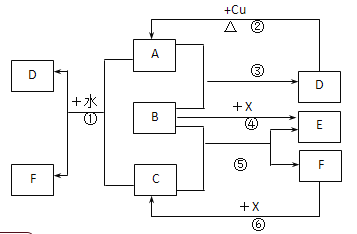
(1)写出反应②的化学方程式:___________________。
(2)写出反应①、⑤的离子方程式:①____________;⑤________________.
(3)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________________.
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Cl2+SO2+2H2O=4H++SO42﹣+2Cl﹣ H2O2+Cl2 = O2+2H++2Cl﹣ MnO2>Cl2>H2O2>H2SO4(稀)
CuSO4+SO2↑+2H2O Cl2+SO2+2H2O=4H++SO42﹣+2Cl﹣ H2O2+Cl2 = O2+2H++2Cl﹣ MnO2>Cl2>H2O2>H2SO4(稀)
【解析】
已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色,则A是SO2;B、D为液体,D的浓溶液在常温下能使铁钝化,则D是硫酸;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,判断反应是制备氯气的反应原理,X为MnO2,C为Cl2,F为HCl;B分子中有18个电子,和二氧化硫反应生成硫酸,说明B是氧化剂,推断B为H2O2,在MnO2的催化作用下过氧化氢分解生成氧气和水,E为O2,据此分析解答。
根据以上分析可知A是SO2,B为H2O2,C为Cl2,D是硫酸,E为O2,F为HCl,X为MnO2,则
(1)根据以上分析可知反应②是浓硫酸与金属铜反应,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)根据以上分析可知反应①是氯气氧化二氧化硫,反应的离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-;反应⑤是氯气氧化双氧水,反应的离子方程式是H2O2+Cl2=O2+2H++2Cl-。
(3)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则依据反应关系:H2O2+SO2=H2SO4、H2O2+Cl2=O2+2HCl、MnO2+4HCl![]() MnCl2+Cl2↑+2H2O可得到氧化性从强到弱的顺序是:MnO2>Cl2>H2O2>H2SO4(稀)。
MnCl2+Cl2↑+2H2O可得到氧化性从强到弱的顺序是:MnO2>Cl2>H2O2>H2SO4(稀)。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】Ⅰ)

(1)实验中能观察到的现象是____________________。(选填代号)
A.试管中镁片逐渐溶解 B.试管中产生无色气泡
C.烧杯外壁变冷 D.烧杯底部析出少量白色固体
(2)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
Ⅱ)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________,除此之外还有一处错误的是____________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值(绝对值)__________(填“偏大、偏小、无影响”)。
Ⅲ)(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)===CO(g)+H2(g)ΔH=E2 ②
H2(g)+1/2O2(g)===H2O(g)ΔH=E3 ③
CO(g)+1/2O2(g)===CO2(g)ΔH=E4 ④
请表达E1、E2、E3、E4之间的关系为E2=_________________。
(2)如图所示在常温常压下,1摩尔NO2 和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________。

(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能如下表所示:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | 434 |
则反应:H2(g)+Cl2(g)=2HCl(g)的焓变ΔH = ____________________。