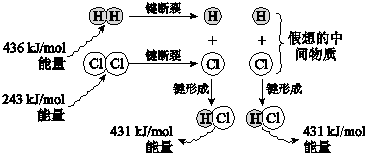
题目内容
2.下列气态氢化物按稳定性由强到弱顺序的是( )| A. | HBr、HCl、HF | B. | HF、H2O、NH3 | C. | NH3、PH3、H2S | D. | SiH4、CH4、NH3 |
分析 元素非金属性越强,气态氢化物稳定性越强,同周期从左到右元素的非金属性依次增强,同主族从上到下元素的非金属性依次减弱,据此解答.
解答 解:A.非金属性:F>Cl>Br,氢化物稳定性:HF>HCl>HBr,故A错误;
B.非金属性:F>O>N,氢化物稳定性:HF>H2O>NH3,故B正确;
C.非金属性:N>S>P,氢化物稳定性:NH3>H2S>PH3,故C错误;
D.非金属性:N>C>Si,氢化物稳定性:NH3>CH4>SiH4,故D错误;‘
故选:B.
点评 本题考查了气态氢化物的稳定性,熟悉元素非金属性判断依据是解题关键,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
13.下列叙述中正确的是( )
| A. | 相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 | |
| B. | 标准状况下,28 g CO和22.4 L SO3所含分子数相等 | |
| C. | 5.6 g铁粉与足量氯气充分反应,有0.2 mol电子转移 | |
| D. | 等物质的量的CH${\;}_{5}^{+}$和NH${\;}_{2}^{-}$所含电子数相等 |
10.下列有关硫酸的说法不正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,故可在常温下用铝制贮藏贮运浓硫酸 | |
| B. | 实验室可利用锌与稀硫酸反应制氢气 | |
| C. | 蔗糖中滴入浓硫酸可观察到蔗糖由白变黑,后体积膨胀并产生大量有刺激性气味的气体,该过程中浓硫酸体现了脱水性和强氧化性 | |
| D. | 在以稀硫酸为电解质溶液的铜、锌原电池中,溶液中的SO42-向原电池的正极移动 |
17.已知化合物A的结构简式为 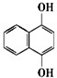 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )| A. | 2n=m | B. | n=m | C. | n+m=6 | D. | n+m=8 |
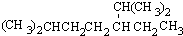
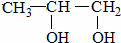 <
< 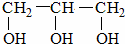 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同) <
<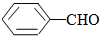
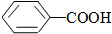 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)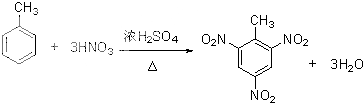 ;
;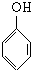 +nHCHO
+nHCHO 
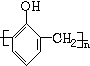 +nH2O.
+nH2O. 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图: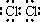 .
.