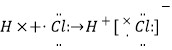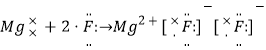题目内容
【题目】如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有3.2g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题: 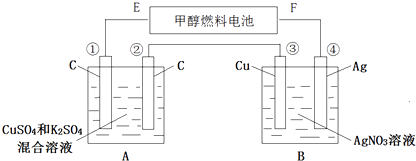
(1)F电极的名称是 , E电极的反应式: .
(2)④电极的反应式: , 通电一段时间后B池pH(填“变大”“变小”“不变”).
(3)若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,电解过程中A池中共收集到标准状况下的气体L,①、③电极析出固体物质的量之比 .
(4)欲使通电后的溶液恢复至原状,可加入一种物质是(写名称).
【答案】
(1)正极; CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O
(2)Ag﹣e﹣=Ag+;不变
(3)6.72;1:4
(4)氢氧化铜
【解析】解:(1)对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,负极上甲醇失电子生成碳酸根离子,则负极电极方程式为:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;
所以答案是:正极;CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O; (2)电解池中,③上银离子得电子生成银单质,④电极上银失电子生成银离子进入溶液,电极反应式为:Ag﹣e﹣=Ag+,B装置中阴极上银离子得电子,阳极上Ag失电子生成银离子,溶液中银离子浓度不变,所以溶液的pH不变;
所以答案是:Ag﹣e﹣=Ag+;不变;(3)设3.2g甲醇反应转移电子的物质的量是x,
CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O | 转移电子 |
32g | 6mol |
3.2g | x |
x= ![]() =0.6mol
=0.6mol
若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,则铜离子的物质的量为0.3mol/L×0.5L=0.15mol,当铜离子完全析出时,铜离子得到电子的物质的量=0.15mol×2=0.3mol<0.6mol,所以电解混合溶液时,阴极上先析出铜后析出氢气,阳极上析出氧气,但得失电子的物质的量都是0.6mol,
设阴极上析出氢气的物质的量是y,阳极上析出氧气的物质的量是z,
则0.15mol×2+2y=4z=0.6mol,y=0.15mol,z=0.15mol,所以A池中共收集到的气体的物质的量是(0.15+0.15)mol=0.3mol,则气体体积=0.3mol×22.4L/mol=6.72L,①上铜离子得电子析出金属铜,铜离子的物质的量为0.3mol/L×0.5L=0.15mol,③上银离子得电子生成银单质,根据电子守恒,转移0.6mol电子析出金属银是0.6mol,两个电极析出固体物质的量之比为1:4,
所以答案是:6.72; 1:4;(4)A中电解生成的物质,阳极生成氧气,阴极上生成氢气和Cu,所以欲使通电后的溶液恢复至原状,可加入一种物质是氢氧化铜;
所以答案是:氢氧化铜.