题目内容
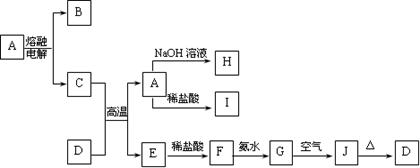
(10分) A、B、C、D四种元素都是短周期元素。A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100ml 2mol/L盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构最外层电子数是次外层电子数的三倍。根据上述条件,回答:
(1)元素C位于第_____周期第_____族,它的最高价氧化物的化学式为_____ _。
(2)A是元素______ ___,B是元素______ ___,D是元素_______ _____。
(3)A与D形成稳定化合物的化学式为_____________,判断该化合物在空气是否变质的简易方法是______ _________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液来吸收,其离子方程式为_____________ ______________。
(1)元素C位于第_____周期第_____族,它的最高价氧化物的化学式为_____ _。
(2)A是元素______ ___,B是元素______ ___,D是元素_______ _____。
(3)A与D形成稳定化合物的化学式为_____________,判断该化合物在空气是否变质的简易方法是______ _________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液来吸收,其离子方程式为_____________ ______________。
(1)3;ⅦA;Cl2O7。(2)Na;Mg;O。
(3)Na2O2;观察该化合物的颜色是否变白。(4)Cl2+2OH—=Cl—+ClO—+H2O
(3)Na2O2;观察该化合物的颜色是否变白。(4)Cl2+2OH—=Cl—+ClO—+H2O
根据元素的结构及有关性质可知, A、B、C、D四种元素分步是Na、Mg、Cl、O。
(1)氯元素的原子序数是17,所以位于第三周期第ⅦA;氯元素的最高价是+7价,所以最高价氧化物是Cl2O7。
(2)略
(3)钠和氧形成的稳定化合物是过氧化钠,化学式为Na2O2;过氧化钠是淡黄色的,变质后变成白色,据此可以鉴别,即观察该化合物的颜色是否变白。
(4)氯气有毒,可用氢氧化钠溶液吸收,方程式为Cl2+2OH—=Cl—+ClO—+H2O。
(1)氯元素的原子序数是17,所以位于第三周期第ⅦA;氯元素的最高价是+7价,所以最高价氧化物是Cl2O7。
(2)略
(3)钠和氧形成的稳定化合物是过氧化钠,化学式为Na2O2;过氧化钠是淡黄色的,变质后变成白色,据此可以鉴别,即观察该化合物的颜色是否变白。
(4)氯气有毒,可用氢氧化钠溶液吸收,方程式为Cl2+2OH—=Cl—+ClO—+H2O。

练习册系列答案
相关题目
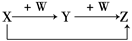 则X、W可能是( )
则X、W可能是( )