��Ŀ����
����Ŀ��һ���¶�������,N2��H2��Ӧ����NH3�Ĺ����������仯��������ͼ��

(1)����_______(�a����b��")�Ǽ������ʱ�������仯����, N��N����Ϊ946kJ/mol,N-H����Ϊ391kJ/mol,��H-H����Ϊ_______kJ/mol��
(2)ˮ����ż���뷽��ʽΪ2H2O![]() H3O++OH-,Һ��Ҳ�ܷ�����ż���룬д��Һ������ż���뷽�̷�Ӧ����ʽ_________;NH2-����ʽΪ________��
H3O++OH-,Һ��Ҳ�ܷ�����ż���룬д��Һ������ż���뷽�̷�Ӧ����ʽ_________;NH2-����ʽΪ________��
(3)����������Һ������Ũ���ɴ�С˳��Ϊ________;������ͨ�뵽����������Һ�п��Ƶ�����(N2H4),д����Ӧ�����ӷ���ʽ__________;����������������ȼ��,�����������ȼ�ϡ���֪:N2(g)+2O2(g)= 2NO2(g),��H,= +67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ/mol;N2O4(g)=2NO2(g),��H3=+ 57kJ/mol,д����̬������������������������ȼ��������������Ⱦ��̬������Ȼ�ѧ����ʽ______��
(4)��2.04mol/L�İ�ˮ��0.02mo/L����������Һ�������ϵõ������Һ�������ϵ�д���ƽ��:Ag+(aq) +2NH3��H2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),ƽ�ⳣ������ʽK=_________;�ڳ���ʱK=1��107,���ڰ�ˮ����,�����Ӽ�����Ӧ��ȫ,�����ʱ�����Һ��c(Ag+)=_________mol/ L��
Ag(NH3)2+(aq)+2H2O(1),ƽ�ⳣ������ʽK=_________;�ڳ���ʱK=1��107,���ڰ�ˮ����,�����Ӽ�����Ӧ��ȫ,�����ʱ�����Һ��c(Ag+)=_________mol/ L��
���𰸡� b 436 2NH3![]() NH4++NH2-
NH4++NH2- ![]() c(Na+)>c(ClO-)>c(OH-)>c(H+) 2NH3+ClO-=N2H4+Cl-+H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);��H= -1078.7kJ/mol
c(Na+)>c(ClO-)>c(OH-)>c(H+) 2NH3+ClO-=N2H4+Cl-+H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);��H= -1078.7kJ/mol ![]() 1��10-9
1��10-9
�����������������(1)��������ܽ��ͷ�Ӧ������ʱ�=��Ӧ����ܼ���-��������ܼ�����(2)����ˮ����ż����дҺ������ż���뷽��ʽ��NH2-�е�ԭ���������8���ӽṹ��(3)����������ǿ���������������������ˮ������Һ�ʼ��������������������Һ��Ӧ������ԭ��Ӧ�����Ȼ��ƺ�N2H4�����ݸ�˹������д��̬������������������������ȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ��(4)���塢��Һ�岻�ܼ���ƽ�ⳣ������ʽ�����ݻ�ѧ����ʽ��2.04mol/L�İ�ˮ��0.02mo/L����������Һ�������ϵõ������Һ��c(NH3��H2O)= ![]() mo/L������c(Ag(NH3)2+)=
mo/L������c(Ag(NH3)2+)=![]() =0.01 mo/L������
=0.01 mo/L������![]() = K=1��107����c(Ag+)��
= K=1��107����c(Ag+)��
������(1)��������ܽ��ͷ�Ӧ�������������b�Ǽ������ʱ�������仯���ߣ�����ͼ���֪N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() =-92 kJ/mol����H-H����ΪxkJ/mol�������ʱ�=��Ӧ����ܼ���-��������ܼ�����-92 kJ/mol=946kJ/mol+3x-
=-92 kJ/mol����H-H����ΪxkJ/mol�������ʱ�=��Ӧ����ܼ���-��������ܼ�����-92 kJ/mol=946kJ/mol+3x-![]() 391kJ/mol��x=436 kJ/mol��(2)����ˮ����ż������Һ������ż���뷽��ʽ��2NH3
391kJ/mol��x=436 kJ/mol��(2)����ˮ����ż������Һ������ż���뷽��ʽ��2NH3![]() NH4++NH2-��NH2-�е�ԭ���������8���ӽṹ��NH2-�ĵ���ʽΪ
NH4++NH2-��NH2-�е�ԭ���������8���ӽṹ��NH2-�ĵ���ʽΪ![]() ��(3)����������ǿ���������������������ˮ������Һ�ʼ�������������Ũ���ɴ�С˳��Ϊc(Na+)>c(ClO-)>c(OH-)>c(H+)�����������������Һ��Ӧ������ԭ��Ӧ�����Ȼ��ƺ�N2H4����Ӧ���ӷ���ʽ��2NH3+ClO-=N2H4+Cl-+H2O��
��(3)����������ǿ���������������������ˮ������Һ�ʼ�������������Ũ���ɴ�С˳��Ϊc(Na+)>c(ClO-)>c(OH-)>c(H+)�����������������Һ��Ӧ������ԭ��Ӧ�����Ȼ��ƺ�N2H4����Ӧ���ӷ���ʽ��2NH3+ClO-=N2H4+Cl-+H2O��
��N2(g)+2O2(g)= 2NO2(g),��H,= -67.7kJ/mol��
��N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ/mol��
�� N2O4(g)=2NO2(g),��H3=+ 57kJ/mol,
���ݸ�˹��������2����������2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);��H= -1078.7kJ/mol��(4) Ag+(aq) +2NH3��H2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),ƽ�ⳣ������ʽK=
Ag(NH3)2+(aq)+2H2O(1),ƽ�ⳣ������ʽK=![]() �����ݻ�ѧ����ʽ��2.04mol/L�İ�ˮ��0.02mo/L����������Һ�������ϵõ������Һ��c(NH3��H2O)=
�����ݻ�ѧ����ʽ��2.04mol/L�İ�ˮ��0.02mo/L����������Һ�������ϵõ������Һ��c(NH3��H2O)= ![]() mo/L������c(Ag(NH3)2+)=
mo/L������c(Ag(NH3)2+)=![]() =0.01 mo/L��
=0.01 mo/L�� ![]() =
=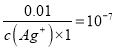 ��c(Ag+)=1��10-9��
��c(Ag+)=1��10-9��

����Ŀ�������ҵ���������Ժ�����ˮ�Ի�������Ⱦ������������Cr(VI)����Ҫ��Ⱦ��ɲ��ö��ַ������������ȥ��
�������Ͽ�֪��
�������Ի����£�Cr��VI��ͨ����Cr2O72-����ʽ���ڣ�Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
��Cr2O72-����������ǿ��CrO42-
�۳����£�����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Cr3+ |
��ʼ������pH | 1.9 | 7.0 | 4.3 |
������ȫ��pH | 3.2 | 9.0 | 5.6 |
I����ʴ��ط�
��1�������Ժ�����ˮ��Ͷ�ŷ���м�ͽ�̿������ԭ���ԭ����ԭCr(VI)�����й��ڽ�̿��˵����ȷ����________������ĸ��ţ���
a. ��ԭ��ص����� b. �ڷ�Ӧ������ԭ�� c. ������������ݲ���
II����ԭ��
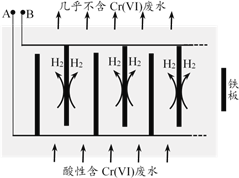
�����Ժ�����ˮ�м�������NaCl���壬��FeΪ�缫��⣬����һ��ʱ�䣬��Cr(OH)3��Fe(OH)3���������ų����Ӷ�ʹ��ˮ�и����������ŷű���װ������ͼ��ʾ��
��2��A�����ӵ�Դ��________����A���ϵĵ缫��Ӧʽ��________��
��3����ʼʱ��B������Ҫ�����ĵ缫��ӦΪ2H++2e-=H2�������������Cr2O72-��B����ֱ�ӷŵ磬�÷�Ӧ�ĵ缫��ӦʽΪ________��
��4���������У���Һ��pH��ͬʱ��ͨ��ʱ�䣨t������Һ��CrԪ��ȥ���ʵĹ�ϵ����ͼ��ʾ��

����ͼ֪����ԭ��Ӧ��ȡ�����pH��ΧΪ________��
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
����������I������IVȥ���ʵ͵�ԭ��________��



